
| A. | 氯化氢分子的电子式: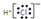 | B. | S2-的结构示意图: | ||
| C. | 四氯化碳的电子式: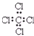 | D. | N2分子的结构式:N=N |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.硫离子的核电荷数为16,核外电子总数为18,最外层满足8电子稳定结构;
C.四氯化碳分子中,氯原子最外层满足8电子稳定结构,漏掉了氯原子的3对未成键电子对;
D.氮气分子中含有的是氮氮三键,不是双键.
解答 解:A.氯化氢分子中不存在氢离子和氯离子,氯化氢正确的电子式为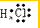 ,故A错误;
,故A错误;
B.硫离子的核电荷数为16,最外层达到8电子稳定结构,硫离子结构示意图为: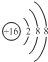 ,故B正确;
,故B正确;
C.四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为 ,故C错误;
,故C错误;
D.氮气分子中含有氮氮三键,其正确的结构式为:N≡N,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧煤炭供热 | B. | 利用风力发电 | C. | 增加植被面积 | D. | 节约用电用水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

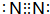 ;⑨的过氧化物
;⑨的过氧化物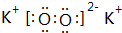 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
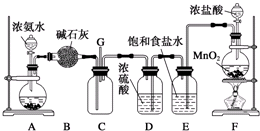
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收10L空气中的CO2(标准状况) | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com