


科目:高中化学 来源:不详 题型:单选题
| A.铁有剩余 |
| B.往溶液中滴入无色KSCN溶液,显红色 |
| C.Fe2+与Fe3+物质的量之比为3:1 |
| D.氧化产物与还原产物的物质的量之比为2:5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
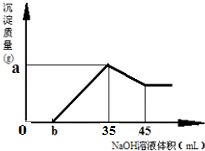
科目:高中化学 来源:不详 题型:问答题
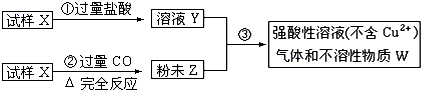
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.05 | B.0.5 | C.0.55 | D.1.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.24mol | B.0.21mol | C.0.25mol | D.0.12mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
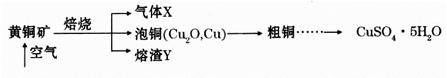


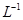 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: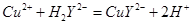 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色 |
| D.漂白粉和水玻璃长期暴露在空气中变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com