(2010?宝鸡三模)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某化学实验小组对组成可能为Fe
2O
3、Cu
2O或二者混合物的红色粉末进行了一系列的实验.
请回答实验中有关问题:
实验一:探究红色粉末的成分
[查阅资料]①Cu
2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO
4,在空气中加热生成CuO.
②Cu能与Fe
2(SO
4)
3溶液作用生成CuSO
4和FeSO
4.
[提出假设]假设1:红色粉末是Fe2O
3假设2:红色粉末是Cu
2O
假设3:红色粉末是Fe
2O
3和Cu
2O的混合物
[设计探究实验]取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN溶液.
(1)若假设1成立,则实验现象是
固体完全溶解,溶液呈血红色
固体完全溶解,溶液呈血红色
.
(2)若假设2成立,则实验现象是
溶液变为蓝色,最终溶液中仍有红色固体
溶液变为蓝色,最终溶液中仍有红色固体
.
(3)若固体粉末完全溶解,滴加KSCN溶液时溶液不变红色,则此时发生反应的离子方程式为
Fe2O3+6H+═2Fe3++3H2O、Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+
Fe2O3+6H+═2Fe3++3H2O、Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+
.
[实验结果]经实验分析,假设3是正确的.
实验二:测定Cu
2O的质量分数
(4)取a g该固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu
2O的质量分数为
.
实验三:利用该红色粉末制取较纯净的胆矾(CuSO
3?5H
2O)
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu
2+、Fe
2+、Fe
3+分别生成沉淀的pH如下表:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1.4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
实验室可供选择试剂有:A.氨水 B.H
2O
2 C.NaOH D.Cu
2(OH)
2CO
3该实验小组设计实验方案如下:
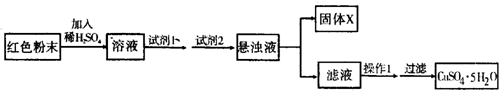
(5)请回答:
①试剂1为
B
B
(从可供选择试剂中选择并填出对应字母编号,②同);
②试剂2为
D
D
;
③固体X的化学式为
Fe(OH)3
Fe(OH)3
;
④操作I为
加热浓缩,冷却结晶
加热浓缩,冷却结晶
.




 (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质]