
| A. | 氯化钠 | B. | 氨气 | C. | NH4Cl的电子式  | D. | 硫化钠 |
分析 A.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
B.N原子的最外层有5个电子,其中3个未成对电子和1对成对电子;
C.氯化铵为离子化合物,氯离子需要标出最外层电子及所带电荷;
D.硫化钠为离子化合物,由2个钠离子和1个硫离子构成.
解答 解:A.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故A错误;
,故A错误;
B.N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,则氨气的电子式为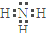 ,故B错误;
,故B错误;
C.NH4Cl为离子化合物,N原子最外层5个电子,Cl原子最外层7个电子,则其电子式为 ,故C错误;
,故C错误;
D.硫化钠为离子化合物,由2个钠离子和1个硫离子构成,两个钠离子和1个硫离子间均以离子键相结合,其电子式为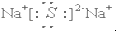 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,侧重考查电子式的书写,明确常见化学用语的书写原则为解答关键,试题有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
| 实验次数 | 温度(℃) | 冷却后(坩埚+试样)的质量(g) |
| 1 | T1 | 48.500 |
| 2 | T2 | 44.900 |
| 3 | T3 | 43.100 |
| 4 | T4 | 43.100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和 浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别在这两种物质的溶液中,加入BaCl2溶液 | |
| B. | 分别在这两种物质的溶液中,加入少量澄清的石灰水 | |
| C. | 分别在这两种固体中,加入同浓度的稀盐酸 | |
| D. | 分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
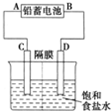 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com