
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
⑴ 2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O ⑵ NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NH3↑+CaCl2+2H2O ⑵ NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
⑶ 2CuS+3O2 2CuO+2SO2 ⑷S2O52-+2H+=2SO2↑+H2O ⑸ CuSO4?5H2O
2CuO+2SO2 ⑷S2O52-+2H+=2SO2↑+H2O ⑸ CuSO4?5H2O
⑹ 2∶1 ①③⑥或①②③⑥
解析试题分析:(1)实验室制取氨气的药品是NH4Cl和Ca(OH)2固体,在加热条件下反应生成氨气。(2)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵。(3)有黑色固体可推知是CuO,说明流程中的CuS被空气氧化成CuO和SO2,根据化合价升降配平即可。(4)Na2S2O5与稀硫酸反应生成SO2,反应中S元素的化合价未发生变化,同时生成硫酸钠与水。(5)CuO与H2SO4生成CuSO4,将溶液CuSO4结晶可得到CuSO4·5H2O晶体。(6)反应Ⅱ中发生反应Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3 Na2S2O5+H2O故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应;碳酸钠的检验可将其转化为CO2气体检验,但SO2会干扰CO2的检验,所以应先除去SO2。
Na2S2O5+H2O故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应;碳酸钠的检验可将其转化为CO2气体检验,但SO2会干扰CO2的检验,所以应先除去SO2。
考点:考查无机化工生产工艺流程。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:填空题
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。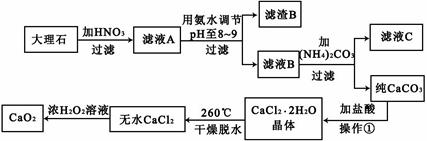
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:

(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____ 。则“轻烧”温度应不超过 _____ 。
(2)流程图中“加热反应”的化学方程式为 _ _________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______ (已知Ksp[Mg(OH)2]=5.61×10-12)。
(4)该工艺中可以循环使用的物质是 、 (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石 的方法,其优点是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:
(1)冶炼过程中得到Cu2O和Cu的混合物称为“泡铜”,其与金属A1在高温条件下混合反应可得粗铜,反应化学方程式为________。粗铜精炼时应将粗铜连接在直流电源的____极,可在____极得到纯度较高的精铜。
(2)传统炼铜的方法主要是火法炼铜,其主要反应为: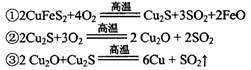
每生成1 mol Cu,共消耗____mol O2。反应③中的氧化剂是____。
(3)炼铜产生的炉渣(含 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:
①加入适量NaClO溶液的目的是_______ (用离子方程式表示)。
②除去Al3+的离子方程式是____。
③选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。所选试剂是____。实验设计:________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
分子筛具有均匀的微孔结构,分子筛筛分作用见下图。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下:

在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%。
(1)分子筛的孔道直径为4A(1 A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用 型分子筛。
(2)A12(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为 ;检验其中金属阳离子的操作方法是
(4)加NH3·H2O调节pH后,加热到90℃并趁热过滤的原因可能是
(5)该生产流程中所得分子筛的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
已知以下四种物质的溶解度曲线图:
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com