
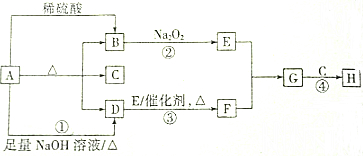
分析 酸式盐A既能与酸反应,也能与碱反应生成气体,且与酸反应生成的气体B能与过氧化钠反应,则A应为碳酸盐或碳酸氢盐,B为CO2,与氢氧化钠反应生成的气体D为NH3,A可能为NH4HCO3,C为H2O,由转化关系可知E为O2,F为NO,G为NO2,H为HNO3,以此解答该题.
解答 解:酸式盐A既能与酸反应,也能与碱反应生成气体,且与酸反应生成的气体B能与过氧化钠反应,则A应为碳酸盐或碳酸氢盐,B为CO2,与氢氧化钠反应生成的气体D为NH3,A可能为NH4HCO3,C为H2O,由转化关系可知E为O2,F为NO,G为NO2,H为HNO3,
(1)D为NH3,工业可用催化氧化法制备硝酸,故答案为:制备硝酸;
(2)反应①的离子方程式为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+CO32-+2H2O,故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+CO32-+2H2O;
(3)反应②为2Na2O2+2CO2=2Na2CO3+O2,反应中只有O元素化合价发生变化,过氧化钠既是氧化剂也是还原剂,如生成1mol氧气,则转移2mol电子,生成1.6g,即0.05mol,则转移电子0.05mol×2=0.1mol,
故答案为:0.1;
(4)反应③的化学方程式为4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;
(5)反应④为3NO2+H2O=2HNO3+NO,反应中只有N元素化合价发生变化,NO2既是氧化剂也是还原剂,由化合价变化可知被氧化的物质与被还原的物质的物质的量之比为2:1,故答案为:2:1.
点评 本题考查无机物推断,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,需要熟练掌握元素化合物知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 所有的盐在水溶液中都能水解 | |
| B. | 盐类水解一定都显酸性或碱性 | |
| C. | 盐类的水解反应是酸碱中和反应的逆反应,因此盐类水解是吸热反应 | |
| D. | 盐类水解抑制了水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
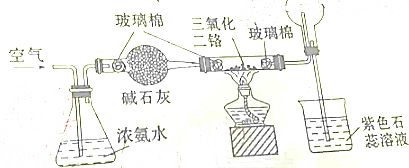
| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com