
| A. | 元素 | B. | 单质 | C. | 氧化物 | D. | 分子 |
科目:高中化学 来源: 题型:解答题
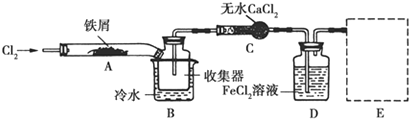
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油里 | |
| B. | 浓硫酸存放在广口试剂瓶中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 氯水应装在棕色细口瓶中密封避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
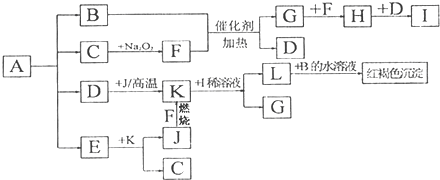
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 检验方法 | 结论 |
| A | 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 未知溶液中一定含有CO${\;}_{3}^{2-}$ |
| B | 向一种未知溶液中滴加NaOH溶液,产生白色沉淀 | 未知溶液中一定含有Al3+ |
| C | 向一种未知溶液中先加入盐酸酸化,再加AgNO3溶液,有白色沉淀生成 | 未知溶液中一定含有Cl- |
| D | 用洁净的铂丝蘸取一种未知液在酒精灯外焰上灼烧火焰呈黄色 | 不能确定未知溶液中一定没有含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3→H2SO4 | B. | HNO3→NO | C. | Fe→FeCl2 | D. | Cl2→HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO${\;}_{3}^{-}$、OH-、Cl- | B. | Fe2+、OH-、NO${\;}_{3}^{-}$ | ||
| C. | Fe2+、H+、Cl- | D. | Na+、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位 | |
| B. | pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度 | |
| C. | 0.2molCO2通入1L0.3mol•L-1KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-) | |
| D. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,每生成1molFe3O4时,转移电子数为4NA | |
| B. | 常温常压下,2.24LCO2的质量大于4.4g | |
| C. | 常温下,1L0.1mol•L-1AlCl3溶液中阳离子数目小于0.1NA | |
| D. | 15.6gNa2O2和Na2S固体混合物中,含有阴离子数目大于0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com