

分析 (1)根据化合物化合价代数和为0结合阴离子结构为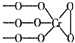 解答;
解答;
(2)Cr3+与Al3+的化学性质相似,则Cr(OH)3为两性氢氧化物;
(3)①A点c(Cr2O72-)=0.25mol/L,c(H+)=10-7mol/L,c(CrO42-)=0.5mol/L,依据平衡常数概念计算,K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}({H}^{+}){c}^{2}(Cr{{O}_{4}}^{2-})}$;
②升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动;
(4)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算;
(5)利用NaHSO3的还原性将废液中的Cr2O72-还原成Cr3+.
解答 解:(1)因为化合物化合价代数和为0,又化学式Na3CrO8中阴离子结构可表示为 ,则氧为-1价,钠为+1价,所以铬为+5,化合物中含有化学键类型为离子键、共价键,
,则氧为-1价,钠为+1价,所以铬为+5,化合物中含有化学键类型为离子键、共价键,
故答案为:+5;离子键、共价键;
(2)Cr3+与Al3+的化学性质相似,则Cr(OH)3为两性氢氧化物,电离方程式为H++CrO2-+H2O?Cr(OH)3?Cr3++3OH-,
故答案为:H++CrO2-+H2O?Cr(OH)3?Cr3++3OH-;
(3)①A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}({H}^{+}){c}^{2}(Cr{{O}_{4}}^{2-})}$=$\frac{0.25}{0.{5}^{2}×(1{0}^{-7})^{2}}$=1.0×1014,
故答案为:1.0×1014;
②升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0,
故答案为:小于;
(4)处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,该反应中得失电子数相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D;
(5)利用NaHSO3的还原性将废液中的Cr2O72-还原成Cr3+,发生反应的离子方程式为:5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O,
故答案为:5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O.
点评 本题考查较为综合,涉及化学反应原理的分析与探究、化学平衡常数、溶度积常数的计算的知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意平衡常数的理解应用,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:
CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:| CO2的量 | NaOH溶液的量 | 放出的热量 | |
| ① | 22.0g | 750mL1.0mol•L-1 | xkJ |
| ② | 1.0mol | 2.0mL1.0mol•L-1 | ykJ |
| 物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
| 浓度/mol•L-1 | 0.2 | 0.8 | a | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深 | |
| C. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| D. | 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请根据所学知识回答下列问题:
请根据所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释时应注意将浓硫酸缓缓地倒入盛有水的容量瓶中 | |
| B. | 将11.2L HCl溶于水形成1L溶液,所得溶液的物质的量浓度为0.5mol/L | |
| C. | 0.5mol/L的Na2SO4和1mol/L的NaOH溶液,c(Na+)相同 | |
| D. | 将20g NaOH 溶于1L水中即得到0.5mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com