
| A. | 加热金属铝使之熔化 | B. | 液态SO3受热蒸发 | ||
| C. | 加热HI气体使之分解 | D. | 加热石英晶体使之熔化 |
科目:高中化学 来源: 题型:解答题
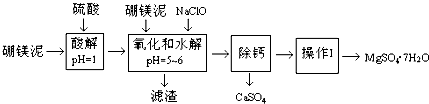
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B的结构简式
,B的结构简式 或
或 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com