
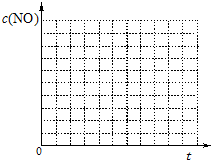
��8�֣� �����ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�
2NO+2CO����2CO2+N2
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�����±���
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO�� /mol��L-1 | 1��00��10-3 | 4��50��10-4 | 2��50��10-4 | 1��50��10-4 | 1��00��10-4 | 1��00��10-4 |
| c��CO�� / mol��L-1 | 3��60��10-3 | 3��05��10-3 | 2��85��10-3 | 2��75��10-3 | 2��70��10-3 | 2��70��10-3 |
��ش��������⣨���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
��1�������������·�Ӧ�ܹ��Է����У���Ӧ��________ ��Ӧ����д�����ȡ��������ȡ�����
��2��ǰ2s�ڵ�ƽ����Ӧ�ٶ�v��N2��=________��
��3���˷�Ӧ��ƽ�ⳣ������ʽΪK=________��
��4�������������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ���������
A��ѡ�ø���Ч�Ĵ��� �������� B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� �������� D����С���������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� |
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO����mol/L�� | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c��CO����mol/L�� | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
| ʵ�� ��� |
T���棩 | NO��ʼŨ�� ��mol/L�� |
CO��ʼŨ�� ��mol/L�� |
�����ıȱ������m2/g�� |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
| �� | 280 280 |
1.20��10-3 1.20��10-3 |
5.80��10-3 5.80��10-3 |
124 |
| �� | 350 | 1.20��10-3 1.20��10-3 |
5.80��10-3 5.80��10-3 |
124 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� |
| �� |
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO��/mol?L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c��CO��/mol?L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
| ʵ�� ��� |
T/�� | NO��ʼŨ��/mol?L-1 | CO��ʼŨ��/mol?L-1 | �����ıȱ����/ m2?g-1 |
| �� | 280 | l.20��10-3 | 5.80��10-3 | 82 |
| �� | 280 280 |
1.20��10-3 1.20��10-3 |
5.80��10-3 5.80��10-3 |
124 |
| �� | 350 | l.20��10-3 l.20��10-3 |
5.80��10-3 5.80��10-3 |
124 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ʱ�� | 0 | 1 | 2 | 4 | 4 | 5 |
| c��NO������10-4mol?L-1�� | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c��NO������10-3mol?L-1�� | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| ʵ���� | T/�� | NO��ʼŨ��/mol?L-1 | CO��ʼŨ��/mol?L-1 | �����ı� �����/m2?g-1 |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 124 |
| �� | 350 | 1.20��10-3 | 5.80��10-3 | 124 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO��/mol?L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c��CO��/mol?L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ʵ���� | T/�� | NO��ʼŨ�� mol?L-1 |
CO��ʼŨ�� mol?L-1 |
�����ıȱ���� �O?g-1 |
| �� | 280 | 1.2��10-3 | 5.8��10-3 | 82 |
| �� | 124 | |||
| �� | 350 | 124 |
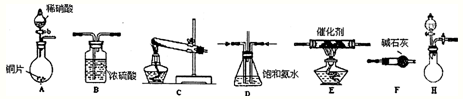
| �Լ������� | �����Լ���g�� | NH3�����mL�� | |
| a | 12.0g Ca��OH��2�������� | 10.8g NH4Cl | 2688 |
| b | 10.8g��NH4��2SO4 | 2728 | |
| c | 12.0g NaOH�������� | 10.8g NH4Cl | 3136 |
| d | 10.8g��NH4��2SO4 | 3118 | |
| e | 12.0g CaO�������� | 10.8g NH4Cl | 3506 |
| f | 10.8g��NH4��2SO4 | 3584 | |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com