
分析 两种气态烃的混合物共1体积,在氧气中完全燃烧得到1.6体积的CO2和2体积的水蒸气,根据相同体积下气体的体积之比等于物质的量之比,可得平均分子式为C1.6H4,利用平均值法确定炔烃烃的可能组成及其体积之比.
解答 解:两种气态烃的混合物1体积在氧气中充分燃烧,生成1.6体积的CO2和2体积的水蒸气,则该混合烃中平均C原子数为:N(C)=$\frac{1.6}{1}$=1,6,平均H原子数为:$\frac{2×2}{1}$=4,该混合烃的平均分子式为C1.6H4,
C原子数小于1.6的只有甲烷,则混合烃中一定含有CH4,
由于甲烷分子中含有4个H,则另一种气态烃分子中含有的H原子数一定为4,且含有的氦原子数≤4,
所以该两种气态烃的可能组合为:①CH4和C2H4、②CH4和C3H4、③CH4和C4H4,
若为:①CH4和C2H4,设甲烷体积为x、乙烯的体积为y,根据平均C原子数为1.6可得:$\frac{x+2y}{x+y}$=1.6,整理可得:x:y=2:3;
若为②CH4和C3H4,设甲烷体积为x、C3H4的体积为y,则:$\frac{x+3y}{x+y}$=1.6,整理可得:x:y=7:3;
若为③CH4和C4H4,设甲烷体积为x、C4H4的体积为y,则:$\frac{x+4y}{x+y}$=1.6,整理可得:x:y=4:1,
答:该两种烃的可能组成及体积比分别为:CH4和C2H4 2:3、CH4和C3H4 7:3、CH4和C4H4 4:1.
点评 本题考查了混合物反应的计算,题目难度中等,明确平均分子式的含义及其应用方法为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用,试题充分培养了学生的分析能力及化学计算能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO2的分子结构呈V型,属非极性分子 | |
| B. | ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害 | |
| D. | 常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
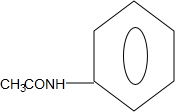 +CO$→_{△}^{HCl}$
+CO$→_{△}^{HCl}$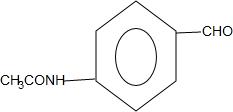 .
.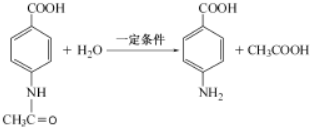 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
.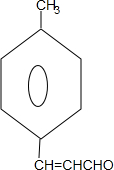 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$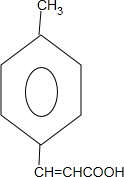 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.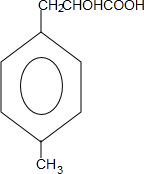 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$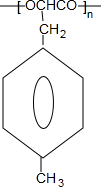 +nH2O.
+nH2O.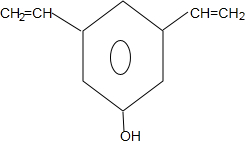 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
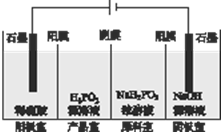 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com