
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
 某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:
某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:| 实验编号 | X | Y | Z |
| ① | 铁 | 石墨 | 足量饱和食盐水 |
| ② | 石墨 | 石墨 | 足量KOH溶液 |
| ③ | ? | ? | 足量?溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
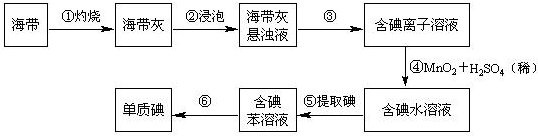
查看答案和解析>>
科目:高中化学 来源: 题型:
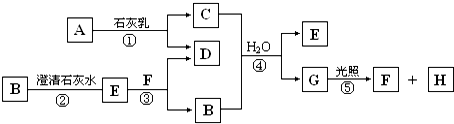
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com