
【题目】下图是古丝绸之路中的重要贸易商品,下列有关说法错误的是
|
|
|
|
瓷器 | 丝绸 | 茶叶 | 酒 |
A.陶瓷由黏土经高温烧结而成,其主要成分是硅酸盐
B.丝绸的化学成分主要是纤维素,纤维素属于天然有机高分子化合物
C.茶叶中含多种酚类物质,经常饮用可抗氧化、防衰老
D.我国劳动人民很早就掌握了酿酒技术,但自酿酒中可能会含有甲醇等有害物质,不建议直接饮用
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
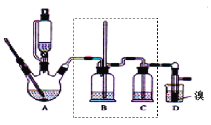
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某离子晶体的晶胞如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,晶体的密度为dg/cm9。下列关于该晶体的说法正确的是( )
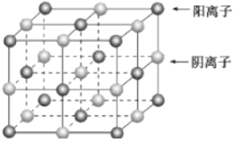
A.晶胞中阴、阳离子的个数都为1
B.阴、阳离子的配位数都是4
C.该晶胞可能是NaCl的晶胞
D.该晶体中两个距离最近的阳离子的核间距为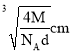
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体 CO2 的研究一直是科技界关注的重点。在催化剂存在下用 H2 还原 CO2 是解决溫室效应的重要手段之一。
已知:①H2 和 CH4 的燃烧热分别为 285.5 kJ/mol 和 890.0 kJ/mol。
②H2O(1)===H2O(g) ΔH=+44 kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式_____。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,其可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2=+41.2kJ/mol
CO(g)+H2O(g)ΔH2=+41.2kJ/mol
对于气体参加的反应,表示平衡常数Kp时,用气体组分(B)的平衡分压p(B)代替该气体的平衡浓度c(B),则反应II的Kp=_____[已知:气体各组分的分压p(B),等于总压乘以其体积分数]。
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1/span>=_____;若此时n2=3.则反应I的平衡常数Kp=_____(无需带单位,用含总压p的式子表示)。
(3)汽车尾气是雾霾形成的原因之一,研究氮氧化物的处理方法可有效减少雾霾的形成。可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)ΔH<0
4N2(g)+6H2O(g)ΔH<0
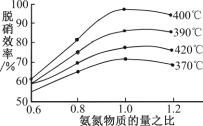
(4)根据图示判断提高脱硝效率的最佳条件是_____;氨氮比一定时,在400℃时,脱硝效率最大,其可能的原因是_____。用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g)ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是______填字母)。
A.通入一定量的 CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通入一定量的 NO E.加入一定量的活性炭 F.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用以下方法处理尾气中的SO2。
方法一:活性炭还原法:
反应原理:恒温恒容2C(s)+2SO2(g)![]() S2(g)+2CO2(g)+Q
S2(g)+2CO2(g)+Q
反应进行到不同时间测得各物质的浓度如图:
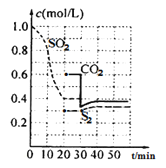
(1)第一次达到平衡的时间是第___min;0~20min化学反应速率表示v(SO2)=___。
(2)30min时平衡发生移动的条件是___。
(3)40min时,平衡常数的计算式为___。(指代入具体数值的算式)
方法二:亚硫酸钠吸收法
(4)Na2SO3溶液吸收SO2的离子方程式为___;
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。
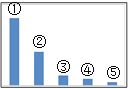
其中③是___。(填微粒符号)
常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__(填序号)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.水电离出c(OH一)=1×l0-8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热为1411.3 kJ·mol1,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
C.用石墨电极电解1 L 0.1 mol·L1 CuSO4溶液,若反应产生0.1 mol O2,则向原溶液中加入0.2 mol CuO能恢复至原浓度
D.用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸钠溶液呈碱性的原因是_______________(写出有关的离子方程式)
(2)在CH3COONa溶液中离子浓度由大到小的顺序为_____________________(用c(Bn+)表示相应离子浓度);
(3)25℃时,0.10mol/L的醋酸溶液的pH约为___________(已知:lg1.3=0.114);
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解.
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是_______;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是____________;
A.0.02molL-1CH3COOH与0.02molL-1NaOH溶液等体积混合液
B.0.03molL-1CH3COOH与0.01molL-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液,则pH(CH3COONa)_______ pH(Na2CO3).(填:“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体4.48L(气体体积均在标准状况下测定,下同),这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法不正确的是![]()
![]()
A.此反应过程中转移的电子为0.6mol
B.消耗氧气的体积是1.68L
C.混合气体中含NO23.36L
D.参加反应的硝酸是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 ( )
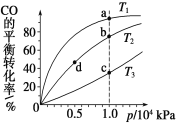
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)>M(c) M(b)>M(d)
D.平衡常数:K(a)<K(c) K(b)=K(d)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com