
【题目】I.某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
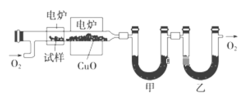
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)
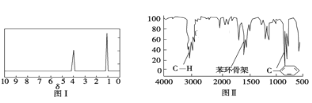
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_________________。
(2)X的分子式为_____________;X的结构简式为___________ ;
II.某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24L,该混合体通入足量的溴水中,溴水增重1.4g。
(1)该混合烃的平均摩尔质量为__________;其中一定含有__________(写名称)。
(2)通过计算,确定另一种烃的分子式为_____________________ 。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)__________________________________ 。
Ⅲ. 已知: ,如果要合成
,如果要合成![]() ,所用的原料可以是___________
,所用的原料可以是___________
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D. 2,3-二甲基-l,3-丁二烯和丙炔
【答案】质谱法 C8H10 ![]() 26g/mol CH4 C4H8 CH2=CH-CH2CH3
26g/mol CH4 C4H8 CH2=CH-CH2CH3 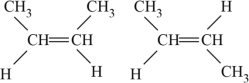
 A、D
A、D
【解析】
I.(1)通过仪器分析得知X的相对分子质量,该方法称为质谱法;
(2)烃X的物质的量为![]() ,生成二氧化碳为
,生成二氧化碳为![]() ,生成水为
,生成水为![]() ,则分子中
,则分子中![]() ,故X的分子式为
,故X的分子式为![]() ;
;
II. (1)![]() ,烯烃的摩尔质量最小为28g/mol,则烷烃的摩尔质量应小于26g/mol,所以混合气体中一定含有甲烷;
,烯烃的摩尔质量最小为28g/mol,则烷烃的摩尔质量应小于26g/mol,所以混合气体中一定含有甲烷;
(2)n(混合)=![]() ,混合气体质量为
,混合气体质量为![]() ,溴水增重1.4g为烯烃的质量,则甲烷的质量为
,溴水增重1.4g为烯烃的质量,则甲烷的质量为![]() ,甲烷的物质的量为
,甲烷的物质的量为![]() ;则烯烃的物质的量为
;则烯烃的物质的量为![]() ,设烯烃的化学式为
,设烯烃的化学式为![]() ,所以
,所以![]() ,故
,故![]() ,解得
,解得![]() ,即烯烃为
,即烯烃为![]() ,
,
(3)丁烯有4种同分异构体,其结构简式分别为 ;
;
Ⅲ.根据1,3-丁二烯与乙炔反应![]() 知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成
知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成![]() ,逆向推断
,逆向推断![]() 或者是
或者是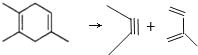 。
。
I.(1)步骤二通过仪器分析得知X的相对分子质量,该方法称为质谱法,
故答案为:质谱法;
(2)烃X的物质的量为![]() ,生成二氧化碳为
,生成二氧化碳为![]() ,生成水为
,生成水为![]() ,则分子中
,则分子中![]() ,故X的分子式为
,故X的分子式为![]() ,X的红外光谱测定含有苯环,属于苯的同系物,而
,X的红外光谱测定含有苯环,属于苯的同系物,而![]() 核磁共振谱有2个峰,其面积之比为2:3,则X为
核磁共振谱有2个峰,其面积之比为2:3,则X为![]() ,
,
故答案为:![]() ;
;![]() 。
。
II. (1)![]() ,烯烃的摩尔质量最小为28g/mol,则烷烃的摩尔质量应小于26g/mol,所以混合气体中一定含有甲烷;
,烯烃的摩尔质量最小为28g/mol,则烷烃的摩尔质量应小于26g/mol,所以混合气体中一定含有甲烷;
故答案为:26g/mol;![]() ;
;
(2)n(混合)=![]() ,混合气体质量为
,混合气体质量为![]() ,溴水增重1.4g为烯烃的质量,则甲烷的质量为
,溴水增重1.4g为烯烃的质量,则甲烷的质量为![]() ,甲烷的物质的量为
,甲烷的物质的量为![]() ;则烯烃的物质的量为
;则烯烃的物质的量为![]() ,设烯烃的化学式为
,设烯烃的化学式为![]() ,所以
,所以![]() ,故
,故![]() ,解得
,解得![]() ,即烯烃为
,即烯烃为![]() ,
,
故答案为:![]() ;
;
(3)丁烯有4种同分异构体,其结构简式分别为 ;
;
故答案为: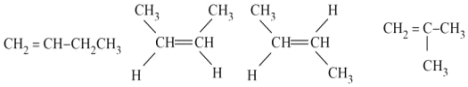 。
。
Ⅲ.根据1,3-丁二烯与乙炔反应![]() 知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成
知,1,3-丁二烯中的两个碳碳双键断裂,中间形成一个碳碳双键,边上两个半键与乙炔中的两个半键相连构成环状,类比1,3-丁二烯与乙炔的加成反应,采用逆合成分析法可知,要合成![]() ,逆向推断
,逆向推断![]() 或者是
或者是 ,若为
,若为![]() ,则有机物的命名原则两种原料分别是2,3-二甲基-1,3-丁二烯和丙炔;若为
,则有机物的命名原则两种原料分别是2,3-二甲基-1,3-丁二烯和丙炔;若为 ,则两种原料分别为2-甲基-1,3-丁二烯和2-丁炔;
,则两种原料分别为2-甲基-1,3-丁二烯和2-丁炔;
故答案为:AD。


科目:高中化学 来源: 题型:
【题目】化合物A是分子式为![]() 的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为
的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为![]() ,有如图所示的转化:
,有如图所示的转化:

已知:
![]() 含羰基的化合物均能与格氏试剂发生如下反应:
含羰基的化合物均能与格氏试剂发生如下反应:![]()
![]()
![]()
![]() 两个羟基连在同一碳原子上极不稳定,易脱水:
两个羟基连在同一碳原子上极不稳定,易脱水: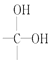 →
→![]() +H2O
+H2O
根据以上信息,回答下列问题:
![]() 写出化合物D中官能团的名称________。
写出化合物D中官能团的名称________。
![]() 写出化合物B、F的结构简式________、________。
写出化合物B、F的结构简式________、________。
![]() 的反应类型是________。
的反应类型是________。
![]() 写出D与
写出D与![]() 反应的化学方程式________________
反应的化学方程式________________![]() 写出
写出![]() 的化学方程式_______________________。
的化学方程式_______________________。
![]() 的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。
的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。![]() 不考虑立体异构
不考虑立体异构![]()
![]() 含有两个取代基
含有两个取代基 ![]() 苯环上的一氯代物只有两种
苯环上的一氯代物只有两种 ![]() 能与足量金属钠反应生成
能与足量金属钠反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1 mol/L的NaOH溶液滴入盛有50 mLpH=2 的HA溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如图。下列说法正确的是( )
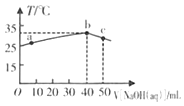
A.a点溶液中,c(A-)+c(HA)=0.08 mol/L
B.b点溶液中,c(A-)<c(Na+)
C.a→b的过程中,发生了吸热反应
D.溶液中HA的电离平衡常数a点等于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、E的焰色反应均为黄色,其中B常用作食品的膨化剂,A与B按物质的量之比为1∶1混合并溶于足量水中,得到的溶液中只含有一种溶质。X为一种黑色固体单质,有多种同素异形体,其氧化物参与大气循环,为温室气体。G为冶炼铁的原料,G溶于盐酸中得到两种化合物,A~H之间有如下的转化关系(部分物质未写出):

(1)写出下列物质的化学式:A________;F________。
(2)B和C反应得到标准状况下的11.2 L D,则产生D的反应中,转移电子的物质的量为________ mol。
(3)写出A+B→E的离子方程式:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于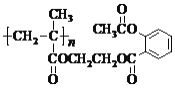 的说法,不正确的是
的说法,不正确的是
A.该物质可由n个单体分子通过缩聚反应生成
B.0.1 mol该物质完全燃烧,生成33.6 n L(标准状况)的CO2
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.1 mol该物质与足量NaOH溶液反应,最多可消耗4n mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
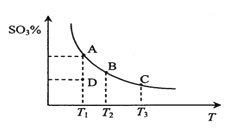
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含有某一氯化物杂质的氯化钙5.55克溶于水后,与足量的硝酸银溶液反应,生成的氯化银沉淀15克,则该杂质可能是
A.氯化钠B.氯化钾
C.氯化铜D.氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S(常温下,氢硫酸的Ka1=5.7×10-8,Ka2=1.2×10-15)广泛存在于天然气、合成氨原料气、炼厂气等,生产中需脱硫处理。回答下列问题
(1)著名的 Vanviel反应为2nH2S+nCO2![]() (CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(2)脱除天然气中H2S的工艺流程如下
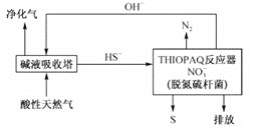
①常温下,“碱液吸收塔”中反应HS-+OH- ![]() S2-+H2O的平衡常数K=________。
S2-+H2O的平衡常数K=________。
②“ THIOPAO”反应器中,在脱氮硫杆菌的作用下,HS-氧化为S的离子方程式为________。
(3)铜(Ⅱ)沉淀及铜(Ⅱ)湿式氧化脱除硫化氢并可回收硫磺,主要步骤如下
(a)吸收H2S
(b)生成CuS沉淀
(c)CuCl2氧化CuS生成单质S和CuCl2-
(d)通O2再生
①常温下,沉淀反应之一:HS-+Cu2+![]() CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
②CuCl2氧化CuS的离子方程式为 ________。
③通O2再生时的离子方程式为________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com