
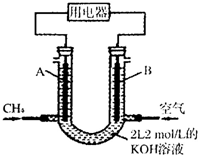
 合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.
合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.分析 (1)甲烷燃料碱性电池中,负极上甲烷失电子和KOH反应生成碳酸钾和水;
(2)用石墨电解饱和食盐水时电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,如果两个电极上共收集到标况下的1.12L气体,则每个电极上得到气体物质的量=$\frac{\frac{1.12L}{22.4L/mol}}{2}$=0.025mol,根据氢气和NaOH之间的关系式得n(NaOH)=2n(H2)=2×0.025mol=0.05mol,c(NaOH)=$\frac{0.05mol}{0.5L}$=0.1mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+).
解答 解:(1)甲烷燃料碱性电池中,负极上甲烷失电子和KOH反应生成碳酸钾和水,则负极电极反应式为CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(2)用石墨电解饱和食盐水时电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,如果两个电极上共收集到标况下的1.12L气体,则每个电极上得到气体物质的量=$\frac{\frac{1.12L}{22.4L/mol}}{2}$=0.025mol,根据氢气和NaOH之间的关系式得n(NaOH)=2n(H2)=2×0.025mol=0.05mol,c(NaOH)=$\frac{0.05mol}{0.5L}$=0.1mol/L,溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+)=-lg10-13=13,
故答案为:13.
点评 本题考查原电池和电解池原理,为高频考点,侧重考查电极反应式的书写及基本计算,明确各个电极上发生的反应及各个物理量之间的关系是解本题关键,注意电极反应式的书写要结合电解质溶液酸碱性书写,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 生石灰、氯水、漂白粉 | B. | 烧碱、液氯、食盐水 | ||
| C. | 干冰、食醋、空气 | D. | 盐酸、氮气、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 另取少量溶液滴加过量氨水,再通入CCl4振荡,静置 | 上层无色,下层呈橙红色 |
| (3) | 取(2)的上层溶液,加入过量Ba(SO4)2溶液和稀硝酸,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
| A. | 肯定含有的离子是Na+、Br-、SO32- | B. | 肯定没有的离子是Ba2+、SO42- | ||
| C. | 不能确定的离子是Na+ | D. | 不能确定的离子是Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
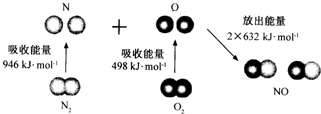
| A. | N2 (g)和O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 molO原子结合生成O2(g)时需要吸收498kJ能量 | |
| C. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444kJ•mol-1 | |
| D. | 1molNO(g)分子中的化学键断裂时需要吸收632kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与烧碱溶液反应 Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 氧化铝和氢氧化钠溶液反应 Al3++3OH-=Al(OH)3↓ | |
| C. | 钠和水反应 Na+2H2O=Na++2OH-+H2↑ | |
| D. | 向稀氯化铵稀溶液中加入稀烧碱溶液 NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉加入稀盐酸中:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+=Ag+Cu2+ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 氢氧化铝与稀硫酸反应:OHˉ+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com