
| A. | Na+、K+、ClO-、Cl- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | Ca2+、HCO3-、NO3-、K+ | D. | Na+、Cu2+、SO42-、NO3- |
分析 强酸性溶液中存在大量的H+离子,与H+离子发生反应的离子不能大量共存,溶液无色,则有颜色的离子不能大量共存.
解答 解:A.在酸性条件下,ClO-离子与H+离子反应而不能大量共存,故A错误;
B.该项离子无色,符合题意,且在酸性条件下,离子间不发生任何反应,能大量共存,故B正确;
C.在酸性条件下,HCO3-离子与H+离子反应生成二氧化碳而不能大量共存,故C错误;
D.Cu2+离子有颜色,不符合题中无色要求,不能大量存在,故D错误.
故选B.
点评 本题考查离子共存问题,题目难度不大,注意从离子之间能否发生反应生成沉淀、气体、弱电解质、氧化还原反应以及相互促进的水解等角度分析,注意题中的隐含信息,例如颜色、酸性、碱性等问题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 P>S>Cl | |
| B. | 最高价氧化物对应水化物的酸性 H3PO4<H2SO4<HClO4 | |
| C. | 氢化物的稳定性 PH3<H2S<HCl | |
| D. | 元素的非金属性 P>S>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,7.8g Na2O2中含有的阴离子的数目为0.2NA | |
| B. | 1mol/L的CaCl2溶液中含有的Cl-为2NA | |
| C. | 1mol金属钠与足量氧气反应生成Na2O或Na2O2时,失去的电子数目均为NA | |
| D. | 常温常压下,18g水中含有的水分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常采用电解法冶炼Y 单质 | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
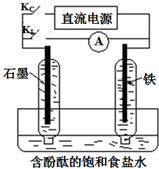 某研究性学习小组设计如下微型实验装置.实验时,先断开KL,闭合KC,两极均有气泡产生;一段时间后,断开KC,闭合KL,发现电流计A指针偏转.下列有关说法正确的是( )
某研究性学习小组设计如下微型实验装置.实验时,先断开KL,闭合KC,两极均有气泡产生;一段时间后,断开KC,闭合KL,发现电流计A指针偏转.下列有关说法正确的是( )| A. | 断开KL,闭合KC时,铁作阴极,总反应方程式为2H2O=2H2↑+O2↑ | |
| B. | 断开KL,闭合KC时,石墨电极附近溶液变红 | |
| C. | 断开KC,闭合KL时,石墨作正极,发生还原反应Cl2+2e-=2Cl- | |
| D. | 断开KC,闭合KL时,铁作负极,发生铁的吸氧腐蚀反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com