
| A、镁合金为电池负极,发生还原反应 |
| B、放电时H2O2在正极反应得电子 |
| C、正极反应式为:Mg-2e-═Mg2+ |
| D、放电时正极附近的酸性增强 |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
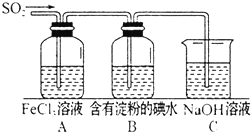 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
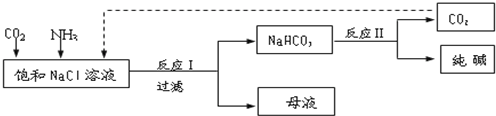
| ||
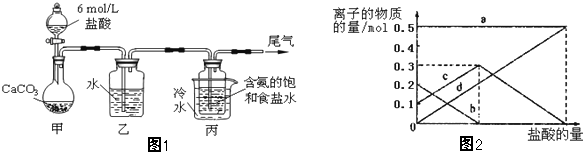
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | C | |
| B |
| A、B的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中C的氢化物稳定性最好 |
| C、原子半径大小关系为:C>A |
| D、C的单质常温下为无色无味的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com