
(本题共12分)碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。

40.采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。
①气体a的成分是____________。
②根据未配平的反应,______+5O2 Fe3O4+3SO2 ,推测钢样中硫以_______形式存在(填写化学式)。
Fe3O4+3SO2 ,推测钢样中硫以_______形式存在(填写化学式)。
将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。

41.H2O2氧化SO2的化学方程式:_____________________________。
42.用NaOH溶液滴定生成的H2SO4,消耗zmL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量数:________。
将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。

43.推测气体a通过B和C的目的可能是_____________________。
44.计算钢样中碳的质量分数,应测量的数据是____________。
40.①O2、CO2和SO2 (2分);②FeS (2分)
41.H2O2+SO2 =H2SO4 ;(2分);42.zy/x (2分)
43.除掉SO2,防止对CO2测定产生干扰(2分)
44.吸收瓶在吸收CO2气体前后的质量(2分)
【解析】
试题分析:40. ①钢样品中的C、S在氧气流中加热发生反应变为CO2、SO2,在气体中除了产生的气体外,还存在过量的未发生反应的O2,气体a的成分是O2、CO2和SO2。②根据元素的原子守恒及电子转移守恒,缺项是FeS则钢样中硫以FeS形式存在;
41.根据电子守恒及原子守恒可得:H2O2氧化SO2的化学方程式是H2O2+SO2 =H2SO4 ;
42.用NaOH溶液滴定生成的H2SO4,消耗zmL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则Zg相当于yzg的S。则该钢样中硫的质量数是(yz÷x);
43.将气体a通过首先通过盛有氧化剂的MnO2来除去SO2,再通过K2Cr2O7和浓硫酸的混合物,进一步除去SO2;防止对CO2测定产生干扰;
44.计算钢样中碳的质量分数,应测量的数据是吸收瓶在吸收CO2气体前后的质量。
考点:考查物质成分的种类、含量、物质的性质及作用的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
已知:S(s)+O2(g)→SO2(g)+297.23kJ………………①
2SO2(g)+O2(g)  2SO3(g) +196.64kJ……②
2SO3(g) +196.64kJ……②
假设反应过程中无热量损失,则
A.1mol S(s)完全反应,并转化为SO3(g)时,放出395.55 kJ热量
B.1个SO2和1个O2分子储存的能量之和大于1个SO3分子
C.1 L SO2(g)完全反应生成1L SO3(g),放出98.32 kJ热量
D.使用催化剂,可以减少反应②放出的热量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)聚合氯化铝(PAC)的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种新兴的高效净水剂。
某兴趣小组尝试以工业废弃物铝灰为原料,利用酸溶法制备聚合氯化铝,主要流程如下:

完成下列填空:
40.用37.5%的浓盐酸配置100 mL 6 mol/L盐酸,所需的玻璃仪器有量筒、烧杯、_______。
41.步骤III调节pH至4.0~4.5,其目的是___________________________。为使得到的PAC晶体较纯净,所用的X物质可以是_______(填编号)。
a.氨水 b.铝 c.氢氧化铝 d.偏铝酸钠
42.步骤IV需要保持温度在85℃,可采用的加热方法是_____________。
43.为测定PAC样品中n的值,可以采用如下方法:
①称取一定质量样品,充分研碎后在_________(填仪器名称)中加热、灼烧至质量不再变化,得到1.020g固体,其成分是_________(填化学式)。
②另称取相同质量的样品,用_________(填化学式)溶解后,加入足量AgNO3溶液,得到3.157 g白色沉淀。
由上可知,该PAC样品中n的值为___________。
44.也可用烧碱溶解铝灰,再用稀盐酸调节pH至4.0~4.5,该法称为“碱溶法”。与“酸溶法”相比,“碱溶法”的缺点是______________________________(任写一点)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
反应条件对化学反应具有影响作用,下列说法中正确的是
A.镁在空气中或纯净氧气中燃烧的产物都只有MgO
B.钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2
C.将四氧化三铁溶解于过量的硝酸,所得溶液中含有Fe3+、Fe2+
D.偏铝酸钠和少量的二氧化碳反应一定得到Al(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
有关化学用语表达,下列正确的是
A.CS2的比例模型:
B.铍原子最外层的电子云图
C.石英的分子式: SiO2
D.氮原子最外层轨道表示式
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
下列各反应对应的离子方程式正确的是
A.向0.1mol NaOH和0.1mol Na2CO3的混合溶液中加入0.04mol稀盐酸2OH―+CO32―+4H+→CO2↑+3H2O
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH-+2HCO3- → CaCO3↓+ CO32-+ 2H2O
C.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 → HCO3-
D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-→ BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
用下图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是

①中实验 | ②中现象 | |
A | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
D | 铁粉与水蒸气加热 | 肥皂水冒泡 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:填空题
15分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如右图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
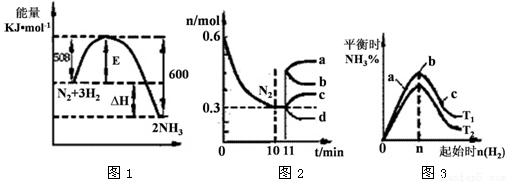
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)-c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com