
【题目】物质的量浓度相等的三种溶液:①H2CO3 ②NaOH ③Na2CO3溶液,下列说法不正确的是( )
A.水电离出的c(H+):③>①>②
B.溶液的pH:②>③>①
C.①和②等体积混合后的溶液:![]()
D.①和③等体积混合后的溶液:![]()
【答案】D
【解析】
A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大、碱中氢氧根离子浓度越大,对水的电离的抑制程度越大,据此判断;
B.NaOH是强碱、碳酸钠是强碱弱酸盐、碳酸是弱酸,据此排序;
C.①和②等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,结合物料守恒判断;
D.①和③等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,据此分析判断。
A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大、碱中氢氧根离子浓度越大,对水的电离的抑制程度越大,①H2CO3为弱酸,②NaOH为强碱,③Na2CO3溶液为能够水解的盐,所以水电离出c(H+):③>①>②,故A正确;
B.NaOH是强碱、碳酸钠是强碱弱酸盐、碳酸是弱酸,所以pH:②>③>①,故B正确;
C.①和②等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,溶液呈碱性,根据物料守恒得![]() ,故C正确;
,故C正确;
D.①和③等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,溶液呈碱性,碳酸氢根离子水解和水的电离都生成氢氧根离子,只有碳酸氢根离子电离生成碳酸根离子,所以离子浓度大小顺序是![]() ,故D错误;
,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜晶体的工艺流程如图所示:
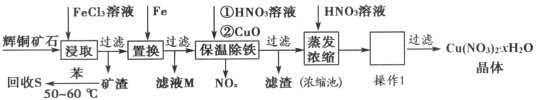
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②__________。
(3)向滤液M中加入(或通入)_______________(填字母),所得物质可循环利用。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(4)“保温除铁”过程中,加入CuO的目的是______________;向浓缩池中加入适量HNO3的作用是_____________。操作1是_______________。
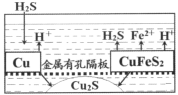
(5)某探究性小组的研究成果如图所示,可以用废铜屑和黄铜矿来富集Cu2S。通入的硫化氢的作用是_____________,当转移0.2mol电子时,生成Cu2S________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g氨基(-ND2)中含有的电子数为10NA
B.56gFe与1molCl2充分反应后转移电子的数目为3NA
C.向密闭容器中加入2molNO和1molO2,充分反应后容器中产物分子的数目为2NA
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,其中NH4+的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A. 盐酸 Na2CO3溶液 B. 氢氧化钠溶液 AlCl3溶液
C. Cl2 铁粉 D. CO2 澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是还原性弱酸,常用于橡胶、医药等工业生产,也可用于制备重要的化工原料[Cu(HCOO)2·4H2O]。
I.碱式碳酸铜的制备
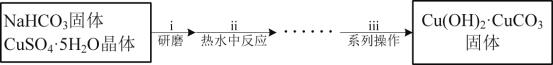
(1)“操作i”中研磨的目的是__。
(2)“操作ii”发生的反应是:2CuSO4+4NaHCO3═Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O。原料中NaHCO3必须过量的原因是__。反应温度低于80℃的原因是__。
(3)“操作iii”中系列操作包括过滤、__、干燥。
II.甲酸的制备
(4)一定条件下,CO能与NaOH固体发生反应:CO+NaOH![]() HCOONa,再将HCOONa酸化,即可得HCOOH。
HCOONa,再将HCOONa酸化,即可得HCOOH。
①为了证明“CO与NaOH固体发生了反应”,甲同学设计下列验证方案:取少许固体产物,配成溶液,在常温下测其pH,若pH>7,则得证。该方案是否可行__(填“是”或“否”),请简述你的理由:__。
②乙同学设计了另一个定性验证方案:取固体产物,配成溶液,__(请补充完整)。
III.甲酸铜的合成及纯度测定
(5)实验室按Cu(OH)2·CuCO3+4HCOOH+5H2O═2Cu(HCOO)2·4H2O+CO2↑反应制得甲酸铜晶体,按以下步骤测定其纯度。
步骤一:准确称取mg甲酸铜晶体样品,配成250mL溶液;
步骤二:移取25.00mL溶液于锥形瓶中,往溶液中加入足量KI摇匀,用cmol/LNa2S2O3溶液滴定至溶液变浅黄色时,加入10mL10%KSCN试剂,并加几滴淀粉溶液,继续用cmol/LNa2S2O3溶液滴定至终点,共消耗Na2S2O3溶液V1mL。
步骤三:用25.00mL蒸馏水代替甲酸铜溶液,重复步骤二,消耗Na2S2O3溶液V2mL;
已知:CuI难溶于水,能吸附I2;2Cu2++4I-=2CuI↓+I2;I2+2![]() =
=![]() +2I-;CuI(s)+SCN-(aq)
+2I-;CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①配制溶液时用到的玻璃仪器有:烧杯、量筒、玻璃棒和__;
②实验中加入10mL10%KSCN试剂的目的是__。
③甲酸铜晶体的纯度__(列表达式即可,Cu(HCOO)2·4H2O的摩尔质量为226g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
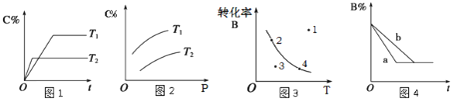
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
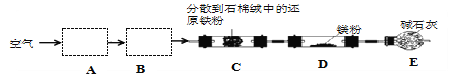
下列说法正确的是( )
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 若去掉装置 C,对产品纯度无影响
C. 实验时应先加热 C,通入一段时间空气后再加热D
D. E 中碱石灰的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com