
【题目】为测定某镁铝合金中镁的质量分数,某小组称取该合金9.0g与足量稀硫酸反应,测得生成氢气的体积为10.08L(标准状况),计算镁的质量分数。
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl-的物质的量浓度之比
A.1 : 3 B. 5 : 2
C.15 : 2 D. 3 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示: 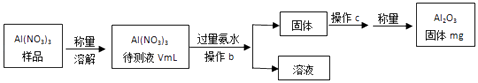
①加入过量氨水后发生反应的离子方程式为: .
②操作b为:
③Al(NO3)3待测液中,c(Al3+)=mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示: 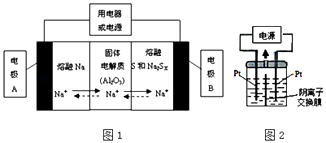
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据表数据,请你判断该电池工作的适宜应控制在(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为极,电极B发生反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为: .
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:;试分析左侧溶液蓝色逐渐变浅的可能原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )
A.物质的量之比为3:2
B.质量之比为3:4
C.摩尔质量之比为9:8
D.体积之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( ) 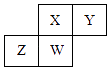
A.最简单气态氢化物的热稳定性:Y>X>W>Z
B.最高价氧化物对应的水化物的酸性:X>W>Z
C.原子半径:W>Z>Y>X
D.元素X,Z,W的最高正价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
A.H2 (g)+Cl2(g)═2HCl(g);△H1 ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g);△H2
Cl2(g)═HCl(g);△H2
B.2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2
C.CO(g)+ ![]() O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2
O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2
D.S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃,101KPa时,1Kg气体A与1Kg气体B的分子数比为n:m
C.同温同压下,气体A与气体B密度比为n:m
D.标准状况下,等质量的A与B的体积比为n:m
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com