
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molFeCl3完全水解生成的Fe(OH)3胶粒数为0.1NA
B.0.1mol/LNa2SO3溶液中离子总数大于0.3NA
C.电解精炼铜时,阴极增重3.2g,电路中转移电子数为0.1NA
D.将0.1molO2与0.2molNO在密闭容器中允分反应,反应后容器内分子数为0.2NA
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用0.2000mol/L的NaOH溶液滴定25.00mL某未知浓度的盐酸(指示剂为酚酞),滴定结果如下:
第一次 | 第二次 | |
NaOH起始读数 | 0.10mL | 0.30mL |
NaOH终点读数 | 18.60mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为__________mol/L。
(2)达到滴定终点的标志是___________。
(3)该同学的实验操作如下:
A.用酸式滴定管移取25.00mL的稀盐酸于锥形瓶中,滴加几滴酚酞试液;
B.用待测的稀盐酸润洗酸式滴定管;
C.检查滴定管是否漏水;
D.用蒸馏水洗干净滴定管;
E.另取锥形瓶,重复操作一次;
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管至“0”刻度以上2cm,再把碱式滴定管固定好,调节液面至“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶至滴定终点,记下滴定管液面所在刻度。
滴定操作的正确顺序是(用序号表示):C;_____;_____;A;C;D;F;G;E。
(4)实验操作G中在锥形瓶下垫一张白纸的作用_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与盐类的水解无关的是( )
A.铝盐用作净水剂B.NaCl用作调味品
C.实验室配制FeCl3溶液时加入盐酸D.用TiCl4制备纳米材料TiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有![]() 、
、![]() 、
、![]() 、Cu。
、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:

①图中X溶液的溶质是______________________;
②Cu电极上发生的电极反应式为_________________;
③原电池工作时,盐桥中的_______________离子![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 不断进入X溶液中。
不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是___________极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_________![]() 溶液才能使所有的金属阳离子沉淀完全。
溶液才能使所有的金属阳离子沉淀完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为________________
(2)装置A中总反应的离子方程式为_____________________________。
(3)若装置E中的目的是在Cu材料上镀银,则X为________,极板N的材料为________。
(4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________L(标准状况下)。
(5)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

①图中a极连接电源的___________极,
②b极电极反应式为____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+CO2↑ + H2OB.CaO+H2O=Ca(OH)2
C.2H2O2 2H2O+O2↑D.CaCO3
2H2O+O2↑D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
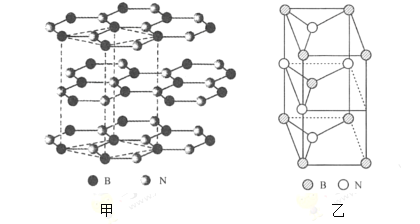
【题目】硼(B)及其化合物在化学中具有十分重要的地位,请回答下列有关问题。
(1)基态硼原子中有_______种能量不同的电子,第一电离能介于B和N之间的第二周期元素有_______种。
(2)硼酸(![]() )能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
)能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。

①硼酸晶体内所含有作用力类型有__________________,根据硼酸的分子结构判断硼酸应属于________(填“强酸”“中强酸”或“弱酸”),你的判断依据是_________________________。
②三氟化硼(![]() )水解生成硼酸和氟硼酸(
)水解生成硼酸和氟硼酸(![]() ),与
),与![]() 互为等电子体的一种阴离子是_________(写化学式)。
互为等电子体的一种阴离子是_________(写化学式)。
(3)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内B—N核间距为acm,层间距为![]() ,晶体密度为
,晶体密度为![]() ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为___________,其结构与石墨相似却不导电,原因是___________________,网状加德罗常数
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为___________,其结构与石墨相似却不导电,原因是___________________,网状加德罗常数![]() ________。(用含
________。(用含![]() 的式子表示)。
的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则95℃时,水的电离平衡曲线应为B,请说明理由______________________.
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是______________.
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______________α2(填“大于”、“小于”、“等于”或“无法确定”)。
(4)曲线B对应温度下,将0.02mol/LBa(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com