
【题目】在生成和纯化乙酸乙酯的实验过程中,下列操作中末涉及的是
A. 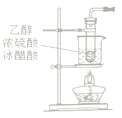 B.
B.  C.
C. 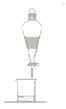 D.
D. 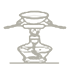
【答案】D
【解析】
乙酸乙酯的制备是乙醇、浓硫酸和乙酸混合溶液加热生成,生成的乙酸乙酯中混有乙酸、乙醇,通过饱和碳酸钠溶液吸收乙醇、中和乙酸、降低乙酸乙酯溶解度,利用分液的方法得的乙酸乙酯,蒸发皿是加热蒸发溶液得到晶体的仪器,据此分析判断。
A.乙酸乙酯的制备是乙醇、浓硫酸和乙酸混合溶液加热生成的,选择试管中加热,不是水浴加热,A不符合题意;
B.生成的乙酸乙酯混有乙酸、乙醇,通过饱和碳酸钠溶液吸收乙醇、中和乙酸、降低乙酸乙酯溶解度,防止倒吸,所以导气管不能深入溶液中,B不符合题意;
C.饱和碳酸钠溶液吸收静置后,由于乙酸乙酯的密度比水小,与水互不相容,所以要通过分液的方法分离,C不符合题意;
D.图中是利用蒸发皿加热蒸发溶液得到溶质晶体的方法,在生成和纯化乙酸乙酯的实验过程中,操作未涉及,D符合题意;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )
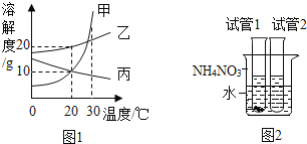
A. 甲物质的溶解度比乙物质的溶解度大
B. 加入试管1的固体是丙
C. 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应2A![]() B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
A. 正反应是吸热反应,且A不是气态
B. 正反应是放热反应,且A是气态
C. 其他条件不变,加入少量A,该平衡向正反应方向移动
D. 改变压强对该平衡的移动无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________。
(2)制备焦亚硫酸钠Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

(3)利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为____________________。(离子交换膜只允许OH-通过)
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
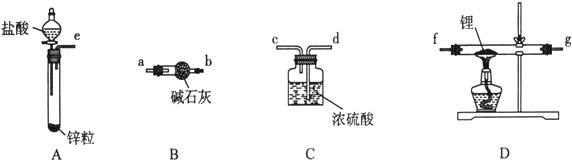
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置按气流从左到右连接顺序为________________,加入药品前首先要进行的实验操作是____________(不必写出具体的操作方法);其中装置B的作用是___________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是____________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,通氢气的作用是___________________________;在加热D处的石英管之前,必须进行的实验操作是__________。
(4)加热一段时间后,停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险,反应方程式为_____________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,下列叙述中不正确的是( )
A. 0.1 mol/L 的 CH3COOH 溶液中加水稀释,溶液中所有离子浓度均减小
B. 醋酸溶液中离子浓度的关系满足:c(H+) = c(CH3COO-) + c(OH- )
C. CH3COOH 溶液中加入少量 CH3COONa(s),平衡逆向移动
D. 常温下,pH = 2 的 CH3COOH 溶液与 pH = 12 的 NaOH 溶液等体积混合后,溶液的 pH < 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质都含有钠元素,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可以反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式:
A________B________C________
D________E________F________
(2)写出F和H反应的化学方程式:______。
(3)写出下列反应的离子方程式:D+盐酸_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定的溶液中一定能大量共存的是
①c(H+)/c(OH- ) = 1×10-10 的溶液中:K+、Na+、CH3COO- 、SO42-
②pH = 13 的溶液中:CO32-、Na+、AlO2- 、Cl-
③由水电离出的 c(H+) = 1×10-12 mol/L 的溶液中:Cl- 、Na+、NO3- 、S2O32-
④使甲基橙变红色的溶液中:Fe3+、NO3 - 、K+、SO42-
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
B. 500℃、30 MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
2NH3(g) ΔH=-92.4 kJ·mol-1将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热46.2 kJ
C. 已知氢气的燃烧热为286 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+572 kJ·mol-1
D. 甲烷的燃烧热为890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com