
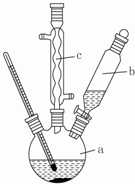
 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�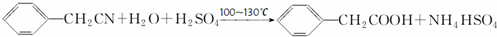 ��
��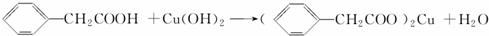
���� ��1�����ƴ�����ʱ��Ӧ���ܶȴ��ע���ܶ�С��Һ���У���ֹ���ʱ�ų���ʹҺ�ηɽ���
��2����ͼ��֪��cΪ�����ܣ�ʹ������Һ����������������b�ɼ��뷴ӦҺ����Ӧ�������������ˮ�������¶ȣ���С��������ܽ�ȣ����뱽�����Ʒ�����ù��˲�����
��3��������������ˮ����ˮ�е��ܽ�Ƚ�С���ɷ�Ӧ +H2O+H2SO4 $\stackrel{100��130��}{��}$
+H2O+H2SO4 $\stackrel{100��130��}{��}$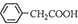 +NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g����4��������ˮϴ�ӳ�������������ϴ�Ӹɾ�����������������ϴ��Һȷ���Ƿ�ϴ�Ӹɾ�����5��������������ˮ�������Ҵ�������ܼ����Ҵ�������������ܽ�ȣ�
+NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g����4��������ˮϴ�ӳ�������������ϴ�Ӹɾ�����������������ϴ��Һȷ���Ƿ�ϴ�Ӹɾ�����5��������������ˮ�������Ҵ�������ܼ����Ҵ�������������ܽ�ȣ�
��� �⣺��1��ϡ��Ũ����ų��������ȣ����ƴ�����ʱ��Ӧ���ܶȴ��ע���ܶ�С��Һ���У���ֹ���ʱ�ų���ʹҺ�ηɽ������������ˮ��Ũ������Ⱥ�˳�����ȼ�ˮ���ټ���Ũ���ᣬ
�ʴ�Ϊ���ȼ�ˮ���ټ���Ũ���
��2����ͼ��֪��cΪ���������ܣ�������Ϊ��������ʹ�����ķ�ӦҺ������������b������Ϊ�μӱ����棻��Ӧ�������������ˮ�������¶ȣ���С��������ܽ�ȣ��������ˮ�ɱ��ڱ��������������뱽�����Ʒ�����ù��˲���������Ҫ������Ϊ©�����ձ�����������
�ʴ�Ϊ��������������ʹ�����ķ�ӦҺ�������� ���ڱ�����������BCE��
��3��������������ˮ����ˮ�е��ܽ�Ƚ�С�����ᴿ������ķ������ؽᾧ���ɷ�Ӧ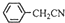 +H2O+H2SO4 $\stackrel{100��130��}{��}$
+H2O+H2SO4 $\stackrel{100��130��}{��}$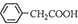 +NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g�����յõ�44g��Ʒ��������IJ�����$\frac{44g}{46.5g}$��100%=95%��
+NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g�����յõ�44g��Ʒ��������IJ�����$\frac{44g}{46.5g}$��100%=95%��
�ʴ�Ϊ���ؽᾧ��95%��
��4��������ˮϴ�ӳ�������������ϴ�Ӹɾ�����������������ϴ��Һȷ���Ƿ�ϴ�Ӹɾ��������ϴ�ɾ���ʵ�������������ȡ���һ������ϴ��Һ������ϡ���ᣬ�ټ���AgNO3��Һ���ް�ɫ���dz��֣�
�ʴ�Ϊ��ȡ�������һ��ϴ��Һ������ϡ���ᣬ�ټ�AgNO3��Һ���ް�ɫ���dz��֣�
��5��������������ˮ�������Ҵ�������ܼ����Ҵ�������������ܽ�ȣ�Ȼ����Cu��OH��2��Ӧ��ȥ�����ᣬ������ܼ����Ҵ������������������ܽ�ȣ����ڳ�ַ�Ӧ��
�ʴ�Ϊ�����������ܽ�ȣ����ڳ�ַ�Ӧ��
���� ���⿼�鱽����ͭ�ĺϳɣ����������Ʊ�ʵ�鼰�л������ʵĿ��飬���պϳɷ�Ӧ��ʵ��װ�õ�����Ϊ���Ĺؼ����ۺϿ���ѧ��ʵ�鼼�ܺͷ�������������������Ŀ�Ѷ��еȣ�ע����Ϣ�Ĵ�����Ӧ�ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮʱ��ƽ��������Ӧ�����ƶ���c��H+������ | |
| B�� | ��������NaOH���壬ƽ��������Ӧ�����ƶ���c��H+������ | |
| C�� | ��������0.1mol•L-1��HCl��Һ��ƽ�����淴Ӧ�����ƶ�����Һ��c��H+������ | |
| D�� | ��������CH3COONa���壬ƽ��������Ӧ�����ƶ���c��CH3COO-������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
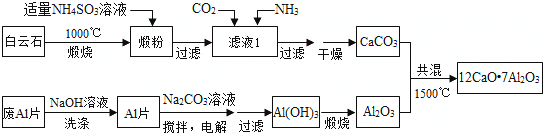
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl��H2 | B�� | H2O2��O2 | C�� | H2SO4��SO2 | D�� | Fe��Fe3O4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
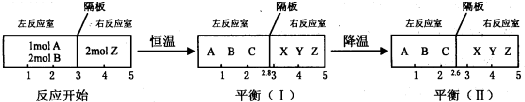
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
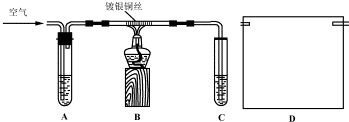
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com