
在Na2CO3溶液中,下列等量关系成立的是
A. c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
B. 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D. c(Na+)+c(OH-)=2c(CO32-)+3c(HCO3-)+4c(H2CO3)+c(H+)
科目:高中化学 来源: 题型:
下列事实能证明甲烷分子是以碳原子为中心的正四面体结构的是
A.四个C-H键完全相同 B.CH4的一氯代物只有一种
C.在常温常压下CH2Cl2为液体 D.CH2Cl2只有一种空间结构
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应速率的说法中,错误的是 ( )
A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.增大反应物浓度,提高反应物温度都能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C. 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
D.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别
为5×104、2。下列说法正确的是
A.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将减小
B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.上述生成Ni(CO)4(g)的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
请回答下列问题:
⑴该反应的平衡常数表达式K= ,ΔH 0(填“>”或“<”)。
⑵1000 ℃时,4 min后达到平衡.求B的平衡转化率为 ,平衡时B的体积分 数 。
⑶欲提高⑵中B的平衡转化率,可采取的措施是
A.减少C的量 B.增加A的量 C.移出部分D
D.降低反应温度 E.减小容器的容积 F.加入合适的催化剂
⑷1000 ℃时, 在一容积为2 L的密闭容器内加入XmolC和0.6 molD,5 min后达到平衡,B的浓度与⑵中B的浓度相同,求X的范围
⑸下列说法中能说明反应已达到平衡状态的是
A.容器内混合气体的压强不随时间变化而变 B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1 D.混合气体的密度保持不变(M(B)≠M(D))
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(如图),下列说法正确的是( )
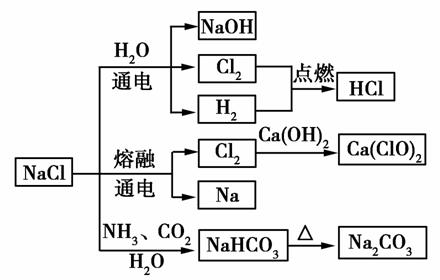
A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.如图所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1molCaCO3分解需要吸收178kJ 热量,1mol焦炭完全燃烧放出393.5kJ ,试回答下列问题
(1)写出碳酸钙分解的热化学反应方程式
(2)试计算如果0.5t CaCO3煅烧成CaO(s),在理论上要用焦炭多少千克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com