
| A£® | ÓÉSiO2²»ÄÜÓėĖ®·“Ӧɜ³ÉH2SiO3£¬æÉÖŖSiO2²»ŹĒH2SiO3µÄĖįōū | |
| B£® | ÓÉSiO2+2C$\frac{\underline{\;øßĪĀ\;}}{\;}$Si+2CO”ü£¬æÉÖŖĢ¼µÄ·Ē½šŹōŠŌ“óÓŚ¹č | |
| C£® | CO2ĶØČėNa2SiO3ČÜŅŗ²śÉś°×É«³Įµķ£¬æÉÖŖĖįŠŌH2CO3£¾H2SiO3 | |
| D£® | SiO2æÉÓėNaOHČÜŅŗ·“Ó¦£¬Ņ²æÉÓėĒā·śĖį·“Ó¦£¬æÉÖŖSiO2ĪŖĮ½ŠŌŃõ»ÆĪļ |
·ÖĪö A£®¶žŃõ»Æ¹čÄŃČÜÓŚĖ®£¬¹čĖį·Ö½āÉś³É¶žŃõ»Æ¹č£¬ĖįōūŹĒĖį¶ŌÓ¦Ńõ»ÆĪļÖŠŌŖĖŲ»ÆŗĻ¼ŪŗĶĖį»ÆŗĻ¼ŪĻąĶ¬£»
B£®øĆ·“Ó¦ÖŠCµÄ»¹ŌŠŌ“óÓŚSiµÄ»¹ŌŠŌ£¬ĪŽ·Ø±Č½ĻC”¢SiµÄ·Ē½šŹōŠŌ£»
C£®Ģ¼ĖįĖįŠŌ“óÓŚ¹čĖį£¬æÉŅŌĒæĖįÖʱøČõĖį£»
D£®Į½ŠŌŃõ»ÆĪļŹĒÖøŗĶĖį¼ī·“Ӧɜ³ÉŃĪŗĶĖ®µÄŃõ»ÆĪļ£¬¶žŃõ»Æ¹čŗĶĒā·śĖį·“Ó¦ŹĒĢŲŹāŠŌ£¬²»ÄÜŗĶĘäĖūĖį·¢Éś·“Ó¦£®
½ā“š ½ā£ŗA£®¶žŃõ»Æ¹čÄŃČÜÓŚĖ®£¬ĖįōūŹĒĖį¶ŌÓ¦Ńõ»ÆĪļÖŠŌŖĖŲ»ÆŗĻ¼ŪŗĶĖį»ÆŗĻ¼ŪĻąĶ¬£¬¹čĖį·Ö½āÉś³É¶žŃõ»Æ¹č£¬¶žŃõ»Æ¹čŹĒ¹čĖįµÄĖįōū£¬¹ŹA“ķĪó£»
B£®øĆ·“Ó¦ÖŠCµÄ»¹ŌŠŌ“óÓŚSiµÄ»¹ŌŠŌ£¬ĪŽ·Ø±Č½ĻC”¢SiµÄ·Ē½šŹōŠŌ£¬·Ē½šŹōŠŌÓ¦øł¾ŻĒā»ÆĪļĪČ¶ØŠŌ”¢×īøß¼Ūŗ¬ŃõĖįµÄĖįŠŌ”¢µ„ÖŹŃõ»ÆŠŌµČ±Č½Ļ£¬¹ŹB“ķĪó£»
C£®Ģ¼ĖįĖįŠŌ“óÓŚ¹čĖį£¬æÉŅŌĒæĖįÖʱøČõĖį£¬CO2ĶØČėNa2SiO3ČÜŅŗ²śÉś°×É«³Įµķ£¬æÉÖŖĖįŠŌH2CO3£¾H2SiO3£¬¹ŹCÕżČ·£»
D£®Į½ŠŌŃõ»ÆĪļŹĒÖøŗĶĖį¼ī·“Ӧɜ³ÉŃĪŗĶĖ®µÄŃõ»ÆĪļ£¬¶žŃõ»Æ¹čŗĶĒā·śĖį·“Ó¦ŹĒĢŲŹāŠŌ£¬²»ÄÜŗĶĘäĖūĖį·¢Éś·“Ó¦£¬¶žŃõ»Æ¹čŗĶ¼īČÜŅŗ·“Ӧɜ³ÉŃĪŗĶĖ®ŹĒĖįŠŌŃõ»ÆĪļ£¬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²é·Ē½šŹōŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ¼°ŠŌÖŹµŻ±ä¹ęĀÉŗĶĖįŠŌ±Č½ĻµČÖŖŹ¶£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶŹµŃéÄÜĮ¦µÄ漲飬ĪŖøßæ¼³£¼ūĢāŠĶ£¬×¢ŅāĻą¹ŲÖŖŹ¶µÄѧĻ°Óė»żĄŪ£¬ÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
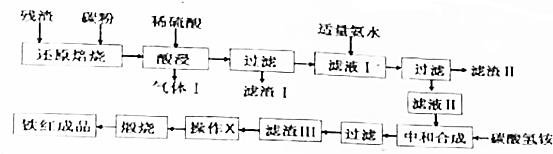
| ½šŹōĄė×Ó | Fe3+ | Al3+ | Fe2+ |
| æŖŹ¼³ĮµķµÄpH | 2.2 | 3.1 | 7.5 |
| ĶźČ«³ĮµķµÄpH | 3.5 | 5.4 | 9.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«ČÜÖŹĪļÖŹµÄĮæÖ®±ČĪŖ 2£ŗ7 µÄČżĀČ»ÆĀĮČÜŅŗŗĶĒāŃõ»Æ±µČÜŅŗ»ģŗĻ£ŗ2Al3++7OH-ØTAl£ØOH£©3”ż+AlO2-+2H2O | |
| B£® | ³ĪĒåŹÆ»ŅĖ®ÓėÉŁĮ抔ĖÕ“ņČÜŅŗ»ģŗĻ£ŗCa2++OH-+HCO3-ØTCaCO3”ż+H2O | |
| C£® | ĻņĮņĖįĒāÄĘČÜŅŗÖŠµĪ¼Ó Ba£ØOH£©2 ÖĮÖŠŠŌ£ŗ2H++SO42-+Ba2++2OH-ØTBaSO4”ż+2H2O | |
| D£® | ³ØæŖĢåĻµ£¬ĻņFeCl2 ČÜŅŗµĪ¼ÓNaOH ČÜŅŗ£ŗ4Fe2++8OH-+O2+2H2OØT4Fe£ØOH£©3”ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
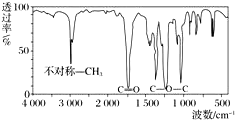 Č”8.8gÓŠ»śĪļX£¬ĶźČ«Č¼ÉÕŗóֻɜ³É7.2gĖ®ŗĶ 8.96L CO2£Ø±ź×¼×“æö£©£¬ŅŃÖŖøĆÓŠ»śĪļµÄÕōĘų¶ŌĒāĘųµÄĻą¶ŌĆܶČĪŖ44£¬ĘäŗģĶā¹āĘ×Ķ¼ČēĶ¼£®¹ŲÓŚXµÄĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©
Č”8.8gÓŠ»śĪļX£¬ĶźČ«Č¼ÉÕŗóֻɜ³É7.2gĖ®ŗĶ 8.96L CO2£Ø±ź×¼×“æö£©£¬ŅŃÖŖøĆÓŠ»śĪļµÄÕōĘų¶ŌĒāĘųµÄĻą¶ŌĆܶČĪŖ44£¬ĘäŗģĶā¹āĘ×Ķ¼ČēĶ¼£®¹ŲÓŚXµÄĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©| A£® | Ęä»ÆѧŹ½ĪŖC4H8O2 | |
| B£® | ĘäĀś×ćÓŅ²ąĶ¼ĻóµÄõ„ÓŠ3ÖÖ | |
| C£® | ¼ų¶ØøĆÓŠ»śĪļµÄ½į¹¹æÉÓĆŗģĶā¹āĘ×»ņŗĖ“Ź²ÕńĒāĘ× | |
| D£® | Čō½į¹¹ĪŖCH3COOCH2CH3£¬ĘäŗĖ“Ź²ÕńĒāĘ×ÖŠÓŠ3øö·å |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ū | B£® | ¢Ł¢Ś | C£® | ¢Ł¢Ū | D£® | ¢Ł¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Fe£Ø NO3£©3ČÜŅŗÖŠ¼ÓČė¹żĮæHIČÜŅŗ£ŗ2Fe3++2I-ØT2Fe2++I2 | |
| B£® | ÅØÉÕ¼īČÜŅŗÖŠ¼ÓČėĀĮʬ£ŗ2A1+2OH-ØT2AlO2-+H2 | |
| C£® | H2SO4ÓėBa£ØOH£©2ČÜŅŗ·“Ó¦£ŗBa2++OH-+H++SO42-ØTBaSO4+H2O | |
| D£® | ½«ŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗ¼ÓČė°±Ė®ÖŠ£ŗCu£ØOH£©2+4NH3•H2OØT[Cu£ØNH3£©4]2++2OH-+4H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹¹³ÉŌµē³ŲÕż¼«ŗĶøŗ¼«µÄ²ÄĮĻ±ŲŠėŹĒĮ½ÖÖ½šŹō | |
| B£® | ÓÉĶ”¢Šæµē¼«ÓėĮņĖįĶČÜŅŗ×é³ÉµÄŌµē³ŲĶŹĒøŗ¼« | |
| C£® | µē×ÓŃŲµ¼ĻßÓÉŠæĮ÷ĻņĶ£¬ĶعżĮņĖįČÜŅŗ±»ĒāĄė×ӵƵ½¶ų·Å³öĒāĘų | |
| D£® | ĶŠæŌµē³Ų¹¤×÷Ź±£¬Šæ±»ĮņĖįČܽā£¬ĖłŅŌ²Å²śÉśµē×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com