
【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表;
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______(填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
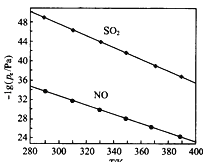
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO42(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ ClO(aq)+2OH(aq)===CaSO4(s)+H2O(l)+Cl(aq)的ΔH=______。
【答案】 2OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O 提高 降低 大于 NO溶解度较低或脱硝反应活化能较高 减小  生成的硫酸钙微溶,降低硫酸根离子浓度,使平衡向正反应方向进行 △H1+△H2-△H3
生成的硫酸钙微溶,降低硫酸根离子浓度,使平衡向正反应方向进行 △H1+△H2-△H3
【解析】(1)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中主要反应的离子方程式为2OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高;②根据反应的方程式2H2O+ClO2-+2SO2=2SO42-+Cl-+4H+、2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐降低;③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高;(2)①由图分析可知,反应温度升高,O2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小;②根据反应的方程式ClO2+2SO32=2SO42+Cl可知平衡常数K表达式为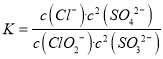 ;(4)①由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好;②已知:①SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
;(4)①由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好;②已知:①SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
②ClO (aq)+SO32 (aq) =SO42 (aq)+Cl (aq) ΔH2
③CaSO4(s)=Ca2+(aq)+SO42(aq) ΔH3
则根据盖斯定律可知①+②-③即得到反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) = CaSO4(s) +H2O(l) +Cl (aq)的ΔH=△H1+△H2-△H3。


科目:高中化学 来源: 题型:
【题目】(1)某固体物质可能含有氯化钾、硫酸铜、氢氧化钠、硝酸镁,硫酸钠中的一种或几种,为鉴定它们,做如下实验:
①将该固体物质全部溶解于水中,得到无色溶液a。
②取少量a溶液于试管中,向其中滴加少量硫酸铁溶液,产生红褐色沉淀
③另取少量a溶液于试管中,向其中滴加少量的硝酸钡溶液,产生白色沉淀
步骤③中发生反应的化学方程式__________________________。据此推断,该固体物质中一定含有(以下写化学式,下同)______________,一定不含有________________,可能含有_____。
(2)下图是初中化学常见六种物质之间的关系图(物质是溶液的只考虑溶质)。图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
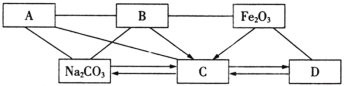
A是一种碱,其中阳离子是人体骨骼中的主要成分,B是胃酸的主要成分。C、D中所含元素种类相同。
①请分别写出A、B、C、D物质的化学式(或溶质的化学式):
A.___________ B.___________ C.___________ D.___________;
②写出Fe2O3反应生成C物质的化学方程式___________________________(写一个);
③写出Fe2O3与足量B反应的实验现象_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法正确的是
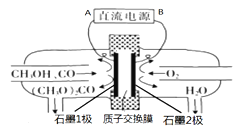
A. B为直流电源正极
B. H+由石墨2极通过质子交换膜向石墨l极移动
C. 石墨l极发生的电极反应为:2CH3OH + CO-2e= (CH3O)2CO + 2H+
D. 电解一段时间后,阴极和阳极消耗的气体的物质的量之比为l∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化物、酸、碱、盐都属于化合物。甲、乙、丙、丁、M是初中化学常见的化合物,其中甲、乙、丙、丁分属上述四种不同类别的化合物,M与甲属于同种类别的化合物。它们之间的部分转化关系如图所示(部分反应物、生成物、反应条件已略去。“—”表示物质之间能发生反应,“→”表示物质之间的转化关系)。下列推论错误的是( )
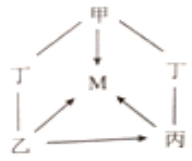
A. 若甲是碳酸钙,则可以用水鉴别乙和丙
B. 若乙可用于改良酸性土壤,则甲可以是氧化铜
C. 若丙是碳酸钠,则甲与丁溶液混合可以得到黄色溶液
D. 若丁是氢氧化钠,则甲可以通过中和反应转化为M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·新课标全国卷Ⅰ)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
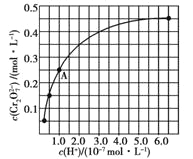
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1) 碳在形成化合物时,其键型以共价键为主,原因是___________________________。
(2) (CN)2分子中,共价键的类型有________________,C原子的杂化轨道类型是____________
(3) CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于________晶体。
(4) 与碳同族的基态Ge原子的核外电子排布式为___________,有________个未成对电子。
(5) 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+xLi++xe→LiC6。其结果是:Li+嵌入石墨的A、B层间。现有某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式:_______。

(6) 碳有多种同素异形体,其中金刚石的晶体晶胞如下图所示:
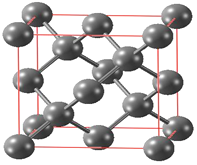
已知金刚石立方晶胞边长a pm,请计算晶体密度____________g/cm3(请用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应的实验装置如图。下列有关铝热反应的说法中,不正确的是
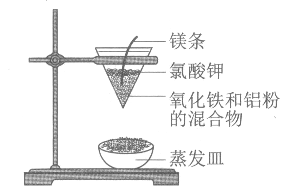
A. 铝热反应是放热反应
B. 铝热反应可用于冶炼某些高熔点金属
C. 实验中镁条的主要作用是还原氧化铁
D. 实验现象为火星四溅,漏斗下方有红热熔融物流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
(2)该反应的能量变化可用下图中的________表示(填序号)。

(3)H2的产生速率随时间的变化如图所示。

t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个,原子的电子层数X比Y、Z少一层。下列说法正确的是
A. 原子半径的大小为:Z>Y>X>W
B. 若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者
C. 元素的非金属性:Y>Z
D. 若X的单质为常见的非金属导体,则Y的简单离子能破坏水的电离平衡
【答案】D
【解析】根据题意W是H元素;X、Y、Z在元素周期表的相对位置是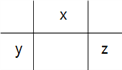 ;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
【题型】单选题
【结束】
6
【题目】特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
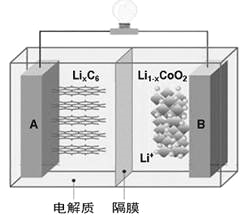
A. 据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 放电时,正极锂的化合价未发生改变
C. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
D. 充电时阳极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com