
| A. | CuSO4 | B. | CO2 | C. | NaOH | D. | H2SO4 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将0.1molCl2全部溶于水形成的1L溶液中:2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=0.2mol•L-1 | |
| B. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | 物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 室温下,向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可盛装热的浓硫酸 | |
| B. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 | |
| C. | K与水反应比Li与水反应剧烈 | |
| D. | 用氢氧化钠溶液吸收二氧化氮时有一氧化氮生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应 KClO3+6HCl═KCl+3Cl2↑+3H2O 中,Cl2既是氧化产物又是还原产物,当得到标准状况下的 67.2 L Cl2 时,反应中转移的电子数为 5NA | |
| B. | 标准状况下,22.4 L 甲苯中含有的 C-H 键数目为 8NA | |
| C. | 50 g 46%的乙醇水溶液中,含氢原子总数目为 3NA | |
| D. | t℃时,MgCO3的 Ksp=4×10-6,则该温度下饱和 MgCO3溶液中含有的 Mg2+数目为 2×10-3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 从100mL 10mol•L-1的浓盐酸中取出10mL | |
| D. | 20g NaOH溶解在水中配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
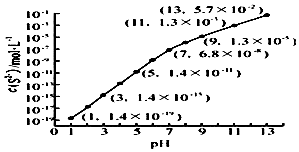 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义. .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com