
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA-A键和1molB-B键,放出akJ能量
C.该反应中反应物的总能量高于产物的总能量
D.该反应热为(a-b)kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠 (Na2S2O3)在生产生活中具有广泛应用。硫化碱法是工业上制取硫代硫酸钠的方法之一。实验室模拟工业生产装置如图所示:
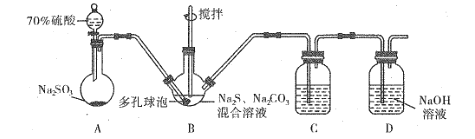
(1)利用如图装置进行实验,为保证硫酸顺利滴下的操作是_______。
(2)装置B中生成的Na2S2O3同时还生成CO2,反应的离子方程式为_______;在该装置中使用多孔球泡的目的是_____。
(3)装置C的作用是检验装置B中SO2的吸收效果,C中可选择的试剂是__(填字母)。
a.H2O2溶液 b.溴水 c.KMnO4溶液 d.BaCl2溶液
(4)Na2S2O3溶液常用于测定废水中Ba2+浓度。
①取废水20.00mL,控制适当的酸度,加入足盐K2Cr2O7溶液,得到 BaCrO4 沉淀,过滤洗涤后用适量稀酸溶解,此时 CrO42-全部转化为Cr2O72-;再加过量 KI溶液,将Cr2O72- 充分反应;然后加入淀粉溶液作指示剂,用0.100 mol/L的Na2S2O3 溶液进行滴定:(I2 +2 S2O32-= S4O62-+ 2I-),滴定终点的现象为__________。平行滴定3次,消耗Na2S2O3 溶液的平均用量为18.00mL。则该废水中Ba2+ 的物质的量浓度为____mol/L,
②在滴定过程中,下列实验操作会造成实验结果偏高的是______(填字母)。
a.滴定管未用Na2S2O3溶液润洗
b.滴定终点时俯视读数
c.锥形瓶用蒸馏水洗涤后未进行干燥处理
d.滴定管尖嘴处滴定前无气泡,滴定终点发现有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8g的沉淀,则加入的NaOH溶液的体积可能为( )
A.150mLB.200mLC.700mLD.400mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
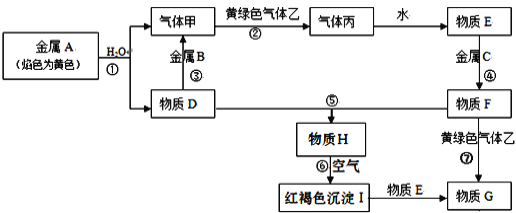
请回答下列问题:
(1)反应③的离子方程式___。
(2)反应⑥化学方程式____。
(3)反应⑦的离子方程式____;物质H在空气中的现象____。
(4)D溶液中加入B的氧化物固体的离子反应方程式为___,向反应后的溶液中通入过量CO2的离子反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是
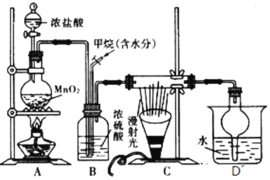
A.实验时先点燃A处酒精灯再通甲烷
B.从D中分离出盐酸的方法为过滤
C.装置C经过一段时间的光照射后,生成的有机物有4种
D.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴蓝(化学式Al2CoO4)是一种耐热、耐光、耐酸、耐碱腐蚀的蓝色颜料。某企业利用含铝锂钴废料(铝箱、CoO和Co2O3、Li2O)制备钴蓝的工艺流程如下:
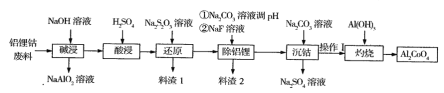
回答下列问题:
(1)碱浸时要有防火、防爆措施,原因是______,操作I的内容是_______。
(2)在实验室模拟工业生产时,也可用盐酸酸浸出钴,但实际工业生产中却不用盐酸,请 从反应原理分析不用盐酸浸出钴的主要原因___。
(3)写出“还原”过程中反应的离子方程式____。
(4)料渣2的主要成分是A1(OH)3 、____,写出灼烧时反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X是一种免疫调节剂,其结构简式为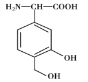 ,下列有关X的说法中错误的是
,下列有关X的说法中错误的是
A.其共平面碳原子最多有9个
B.既能与钠反应也能与NaHCO3溶液反应
C.能发生加成反应
D.X分子间能发生取代反应但分子内不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的铜和 Fe2O3 的混合物中加入 200mL1.5 mol·L-1的稀硫酸,完全反应后固体无剩余,得到的溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法正确的是( )
A.原混合物中 Cu 和 Fe2O3 的质量之比为 1∶2
B.反应后的溶液中 CuSO4 的物质的量的浓度为 1mol/L
C.若用 CO 还原等质量的原混合物,充分反应后,质量将减少 4.8 克
D.该反应过程均发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com