
| 编号 | 实验内容 | 实验目的 |
| A | 将含有HCl杂质的CO2通入饱和Na2CO3溶液中 | 除去CO2中的HCl |
| B | 将一定量的KNO3和NaCl的混合液加热并浓缩至有晶体析出,趁热过滤 | 分离出NaCl晶体 |
| C | 在含有少量FeCl3的MgCl2酸性溶液中加入足量MgO并过滤 | 除去溶液中的FeCl3 |
| D | 在含有少量Na2S的NaCl溶液中加入AgCl,再过滤 | 除去溶液中的Na2S |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
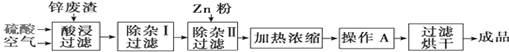
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
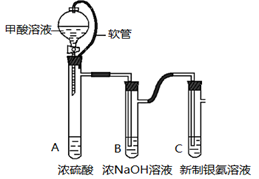
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
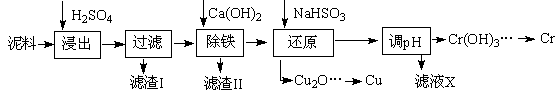
| | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
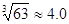 )
)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入AgNO3溶液有白色沉淀产生 |
| B.加入稀盐酸有无色无味气体产生,该气体可使澄清的石灰水变浑浊 |
| C.加入MgCl2溶液有白色沉淀产生,再加入稀盐酸沉淀溶解,并产生可使澄清石灰水变浑浊的无色无味气体 |
| D.加入Ba(OH)2溶液有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
查看答案和解析>>
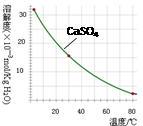
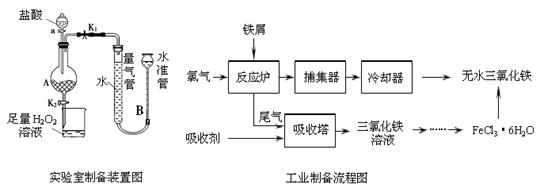
科目:高中化学 来源:不详 题型:实验题
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- |
| B.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
| C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ |
| D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸、硫酸 | B.盐酸、氢氧化钠溶液 |
| C.氨水、硫酸 | D.氨水、氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com