
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 浓H2SO4不稳定,光照易分解 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
分析 A、氨很容易液化,液态氨汽化时要吸收大量的热,使周围物质的温度急剧下降,所以氨常作为制冷剂;
B、根据与金属反应时的剧烈程度来比较氧化性强弱;
C、浓硫酸很稳定;
D、二氧化碳不是大气污染物.
解答 解:A、因NH3易液化,液氨常用作制冷剂,故A正确;
B、与金属反应时,稀HNO3被还原为NO,反应缓慢,浓HNO3被还原为NO2,反应剧烈,所以稀HNO3的氧化性弱于浓
HNO3,故B错误;
C、浓硫酸很稳定,在光照条件下不分解,易见光分解的是浓硝酸,故C错误;
D、二氧化碳不是大气污染物,不能形成酸雨,故D错误.
故选A.
点评 本题主要考查了氮元素及其化合物的有关基础知识.注意酸雨的形成因素,难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
 钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:
某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | D固体 | G溶液 | |
| 颜色 | 银白色 | 棕黄色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | |
| D. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下物质的量浓度相等的①(NH4)2CO3溶液、②(NH4)2SO4溶液和③NH4Cl溶液中,水的电离程度:①>③>② | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)=c(Cl-) | |
| C. | 某溶液中水电离出的c(H+)=1.0×10-12mol/L,则此溶液中K+、HCO3-、Cl-、SO32-可以大量共存 | |
| D. | 0.1mol氯气与足量氢氧化钠溶液(常温)反应,转移电子0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 海盐经过溶解、过滤、蒸发制纯净的NaCl | |
| C. | CO2气体混有少量HCl气体,将气体通过盛有饱和Na2CO3中溶液的洗气瓶以除去HCl气体 | |
| D. | 分液操作时,分液漏斗中先把下层液体从下口放出,再把上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
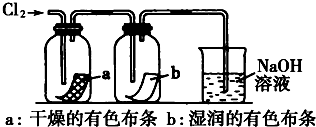
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com