
| A. | 在2 min末的反应速率,用B表示是 0.3 mol/(L•min) | |
| B. | 用A表示的反应速率是0.4 mol/(L•min) | |
| C. | 若乙容器中也同时进行此反应,且相同时间段内用D表示的速率是0.2 mol/(L•min),则乙容器中反应速率更快 | |
| D. | 对甲容器升高温度,则正反应速率将减小 |
分析 A.经2min,B的浓度减少0.6mol/L,2min内v(B)=$\frac{0.6mol/L}{2min}$=0.3mol/(L.min),反应速率与物质浓度成正比;
B.A是固体,反应过程中没有浓度变化量;
C.同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,反应速率越大,反应越快;
D.升高温度,活化分子百分数增大,正逆反应速率都增大.
解答 解:A.经2min,B的浓度减少0.6mol/L,2min内v(B)=$\frac{0.6mol/L}{2min}$=0.3mol/(L.min),该反应速率是平均反应速率而不是即时速率,且反应速率与物质浓度成正比,则2 min末的反应速率小于0.3mol/(L.min),故A错误;
B.A是固体,反应过程中没有浓度变化量,所以不能用A表示反应速率,故B错误;
C.同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,反应速率越大,反应越快,如果D的反应速率是0.2mol/(L.min),则C的反应速率为0.4mol/(L.min),大于甲,故C正确;
D.无论吸热反应还是放热反应,升高温度,活化分子百分数增大,分子之间的有效碰撞机会增大,所以正逆反应速率都增大,故D错误;
故选C.
点评 本题考查化学反应速率的影响因素、表示方法等知识点,注意计算的反应速率是平均反应速率而不是即时反应速率,不能用固体或纯液体表示反应速率,易错选项是AB.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
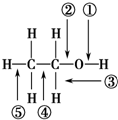
| A. | 和金属钠作用时,键①断裂 | |
| B. | 在铜催化下和氧气反应时,键①和③断裂 | |
| C. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| D. | 和乙酸、浓硫酸共热时,键②断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 欲除去混在苯中的少量苯酚,可加入过量溴水,过滤 | |
| C. | 乙烷和丙烯的物质的量各1mol,完全燃烧各生成3molH2O | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
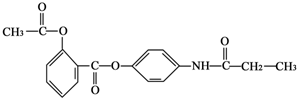
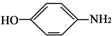 四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是:
四种有机物,且相对分子质量大小关系为B>C>D.则B、C、D 的结构简式分别是: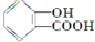 ;CCH3COOH;DHCOOH.
;CCH3COOH;DHCOOH.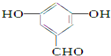 .
.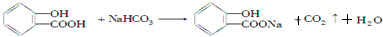 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
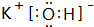 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4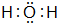 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.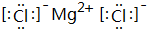 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石灰石-石膏法可以消除燃煤烟气中的二氧化硫,同时还得到副产品石膏(CaSO3•2H2O)和亚硫酸铵 | |
| B. | 利用太阳能光电转化材料组装的器件,只要光电转化效率都达到10%,利用太阳投射到地球上能量的0.1%就能满足当前全世界能源需要 | |
| C. | 借助扫描隧道显微镜,能实现对原子或分子的操纵 | |
| D. | 道尔顿提出的原子学说、阿伦尼乌斯创立的电离学说、门捷列夫提出的元素周期律都对化学学科的发展作出了重要的贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能与NaOH溶液反应,苯酚则能跟NaOH溶液反应 | |
| B. | 乙醛一定条件下能与氢气发生加成反应,乙酸一般不能与氢气发生加成反应 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,甲苯则能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对该反应体系加热 | B. | 加入少量NaCl溶液 | ||
| C. | 不用锌片,改用锌粉 | D. | 加入少量1 mol•L-1硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com