
分析 (1)亚硫酸根离子具有强的还原性,能够被氧气氧化生成硫酸根;
(2)二价铁离子具有强的还原性,能够被氧气氧化生成三价铁离子;三价铁离子具有强的氧化性,能够氧化碘离子生成单质碘.
解答 解:(1)亚硫酸钠被氧化生成硫酸钠,化学方程式:2Na2SO3+O2=2Na2SO4;
故答案为:2Na2SO3+O2=2Na2SO4;
(2)二价铁离子具有强的还原性,能够被氧气氧化生成三价铁离子,离子方程式:4Fe2++4H++O2=4Fe3++2H2O;
三价铁离子具有强的氧化性,能够氧化碘离子生成单质碘,离子方程式:2Fe3++2I-=2Fe2++I2;
故答案为:4Fe2++4H++O2=4Fe3++2H2O;2Fe3++2I-=2Fe2++I2.
点评 本题考查了离子方程式的书写,明确亚硫酸根离子的还原性,二价铁离子的还原性与氧化性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  铁钉易被腐蚀 | |
| B. |  滴加少量KSCN溶液,溶液变为血红色 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 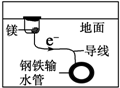 用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 实验室制取干燥的NH3 | 试管、酒精灯、带导管的橡皮塞 | NH4Cl、Ca(OH)2、碱石灰 |
| D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、酚酞试剂、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠(固体) | B. | 水 | ||
| C. | 硫酸钾溶液 | D. | 10 mL1mol•L-1 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为: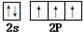 .
.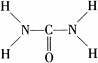 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用铝制容器盛装稀硫酸 | B. | Na2O2可用作供氧剂 | ||
| C. | Fe2O3常用于制造红色油漆和涂料 | D. | Si可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素形成的化合物都是共价化合物 | |
| B. | 酸、碱发生反应,只要生成1mol水放出的热量就相同 | |
| C. | 原电池工作时电流从正极流向负极 | |
| D. | 某物质溶于水得到的溶液可以导电,则该物质一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com