
 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y物质的量之比为| A.2:1 | B.1:1 | C.2:3 | D.3:2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:不详 题型:单选题
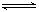 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
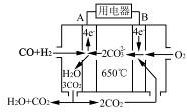
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是
pC(g) △H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是| A.C的体积分数下降 |
| B.a + b > p |
| C.正反应速率和逆反应速率均减小,平衡向逆反应方向移动 |
| D.正反应速率和逆反应速率均加大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )
3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( ) 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。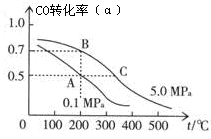
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用完的干电池可以随意地丢弃 |
| B.增加炼铁高炉的高度不可以降低尾气中CO的含量 |
| C.使用催化剂一定能加快化学反应速率 |
| D.把煤粉碎了再燃烧可以降低环境污染 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 + H2(g) ΔH< 0
CO2 + H2(g) ΔH< 0
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
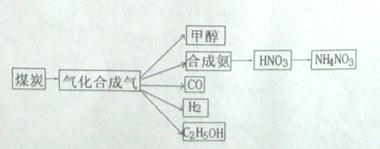
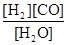 ,它所对应的化学反应为:
,它所对应的化学反应为:  2C0(g),K1 ①
2C0(g),K1 ① H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ② CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③ K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
 2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )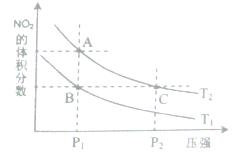
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com