
 NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下
NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下分析 (1)①常温时,水的离子积常数为l.0×l0-14;0.1mol•L-1NH4Al(SO4)2溶液的PH=3是因为铵根离子和铝离子的水解;
②据物料守恒分析;根据电荷守恒计算;
(2)NH4Al(SO4)2水解,升高温度其水解程度增大;
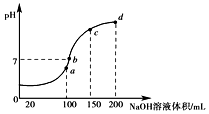
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性;
②向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
解答 解:(1)①常温时,水的离子积常数为l.0×l0-14;0.1mol•L-1NH4Al(SO4)2溶液的PH=3是因为铵根离子和铝离子的水解,所以由水电离的c(H+)=l.0×l0-3mol/L,
故答案为:l.0×l0-14;l.0×l0-3;
②据物料守恒,NH4Al(SO4)2中N原子与Al原子个数比为1:1,所以c(NH4+)+c(NH3•H2O)=c (Al3+)+c( Al(OH)3);根据电荷守恒得2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1-10-11mol•L-1=10-3-10-11mol•L-1,
故答案为:=;10-3-10-11;
(2)NH4Al(SO4)2水解,升高温度其水解程度增大,pH减小,故答案为:NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,所以d点水的电离程度最小,故答案为:d;
②向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为H++OH-=H2O,
故答案为:H++OH-=H2O;
③NH4HSO4的电离方程式为NH4HSO4=NH4++H++SO42-,还有水的微弱电离,铵根离子因微弱水解导致浓度略有减小,所以离子浓度由大到小的顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-),故答案为:c(H+)>c(SO42-)>c(NH4+)>c(OH-).
点评 本题考查盐类的水解和离子浓度大小的比较,题目难度较大,(3)③为易错点,注意根据水的电离和铵根水解都很微弱.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Z>W | |
| B. | 简单离子半径:X>W | |
| C. | 元素X与氧可形成既含离子键也含非极性共价键的化合物 | |
| D. | X、Y、Z的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液 | B. | Na2SiO3溶液 | C. | BaCl2溶液 | D. | Ca(ClO)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | C12H22O11 | BaSO4 | NaOH | H3PO4 |
| 弱电解质 | CH3COOH | HF | NH3•H2O | HClO |
| 非电解质 | S | CO2 | 盐酸 | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排饱和氯化铵溶液的方法收集氨气 | |
| B. | 用重结晶的方法除去BaSO4固体中混有的NaCl | |
| C. | 将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com