
| A、氧化铝的熔点很高,所以不可以用来冶炼铝 |
| B、氢氧化铝可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂 |
| C、实验室可以用过量氢氧化钠与氯化铝来制备氢氧化铝 |
| D、氢氧化铝既可与酸反应又可与碱反应,是两性氢氧化物 |


科目:高中化学 来源: 题型:
| A、乙烯、苯、氯乙烯所有原子都在同一个平面上 |
| B、乙醇、乙酸均能与Na反应放出H2,二者分子中有相同的官能团 |
| C、葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 |
D、苹果醋是一种常见的有机酸,其结构简式为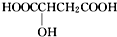 在标准状况下,1mol苹果醋与足量的金属钠反应生成的11.2L氢气 在标准状况下,1mol苹果醋与足量的金属钠反应生成的11.2L氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、135 |
| B、64g?mol-1 |
| C、64 |
| D、135g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
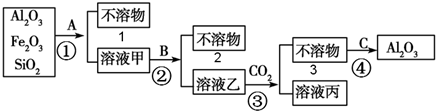
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、刚充入时反应速率v(正)增大,v(逆)增大 |
| B、达到新的平衡时,反应混合物中A、B的体积分数减小 |
| C、充入A、B、Q后,体系压强先增大,后逐渐减小 |
| D、若B为有色物质,达到新平衡后混合气颜色比原平衡浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com