
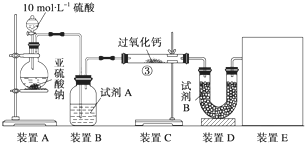
分析 [实验一]:(1)过氧化钙和水反应,装置B中试剂能吸收水蒸气,干燥二氧化硫试剂选择浓硫酸;
(2)测定氧气的体积利用排水量气法,据此画出装置图;
(3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),若SO2未被氧化、CaO2与SO2反应生成CaSO3;若全部氧化生成硫酸钙,介于两者之间的为部分氧化,据此书写化学方程式和V与m1的关系式;
[实验二]:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究
假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;证明SO2部分氧化;
(4)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
(5)过氧化钠具有氧化性,若Na2O2剩余,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的.
解答 解:[实验一]:(1)用亚硫酸钠和硫酸反应生成硫酸钠和二氧化硫和水,因过氧化钙能和水反应,装置B中试剂能吸收水蒸气,所以选择浓硫酸干燥二氧化硫,除去二氧化硫中的水蒸气,
故答案为:浓硫酸;
(2)测定氧气的体积利用排水量气法:装置为以下几种装置中的一种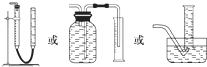 ,
,
故答案为: ;
;
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2CaO2+2SO2=2CaSO3+O2
依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 反应增重
1mol 96g
$\frac{VL}{22.4L/mol}$ m1g V=$\frac{7{m}_{1}}{30}$L,
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4;反应过程中 无氧气生成,V=0
若0<V<$\frac{7{m}_{1}}{30}$,则二氧化硫部分被氧化;
故答案为:$\frac{7{m}_{1}}{30}$;0<V<$\frac{7{m}_{1}}{30}$;CaO2+SO2=CaSO4;
[实验二]:(4)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
故答案为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
故答案为:若Na2O2剩余,固体加水溶解,过氧化钠能将亚硫酸根离子氧化成硫酸根离子.
点评 本题考查了二氧化硫性质应用和实验验证,实验设计的步骤和实验方案的确定应根据题干要求分析判断,关键是读懂题干信息,依据题干条件计算判断,题目难度较大.


科目:高中化学 来源: 题型:多选题
| A. | 赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀制成的 | |
| B. | 正常雨水的PH为7 | |
| C. | 生物质能的缺点是严重污染环境 | |
| D. | 煤、石油、沼气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
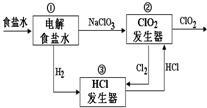 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂,向海水中加入明矾可以使海水淡化 | |
| B. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| C. | 臭氧是一种氧化性较强的气体,可用于自来水的消毒 | |
| D. | SO2具有还原性,可用已知浓度的KMnO4溶液测定食品中SO2残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com