


分析 (1)根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态;
(2)依据热化学方程式的书写方法和注意问题写出,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ,2mol C2H6在氧气中完全燃烧生成CO2和液态水放热3116.6 kJ/,;
(3)根据盖斯定律来解答;依据反应热=拆化学键吸收的能量-形成化学键放出的能量来解答.
解答 解:由图可以看出,molN2(g)+$\frac{3}{2}$molH2(g)的能量为akJ,1molNH3(g)的能量为bkJ,
所以 $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g);△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(l);△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1.
故答案为:-2(b+c-a)kJ•mol-1(或2(a-b-c)kJ•mol-1)
(2)1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ,2mol C2H6在氧气中完全燃烧生成CO2和液态水放热3116.6 kJ/,依据热化学方程式的书写原则结合定量关系写出反应为生成物、各物质的聚集状态、对应反应的焓变得到热化学方程式为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
故答案为:2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l)△H=-3116.6 kJ/mol;
(3)①H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol
②4HCl(g)+O2(g) $\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
根据盖斯定律①×2+②得:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,
2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,则得到H-O的键能=463.4kJ;
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol;463.4.
点评 本题考查了热化学方程式的书写原则和注意问题,盖斯定律的应用,键能计算焓变的方法,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则:2H+(aq)+SO${\;}_{\;}^{2-}4$(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1, 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2 800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1 400 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
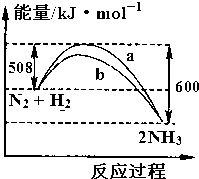
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 在N2+3H2?2NH3中,反应物的键能之和大于生成物的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ | |
| C. | 石灰石与盐酸反应:CO32-+2 H+═H2O+CO2↑ | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com