

| c(SO42-) |
| c(CO32-) |
| x |
| 2.0-x |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中碳酸氢根电离的氢离子浓度为10-10mol?L-1 |
| B、c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C、溶液中水电离的氢氧根离子浓度为10-4mol?L-1 |
| D、c(Na+)+c(H+)=c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数和气体质量均不同 |
| B、分子数和电子数均相同 |
| C、质子数和中子数均相同 |
| D、分子数、原子数和中子数均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
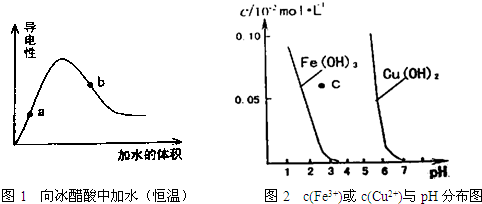
| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:a点的比b点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调PH约为4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧SO3 |
⑨NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| B、25℃时,pH=13的Na2CO3溶液中由水电离出的OH-数目为0.1NA |
| C、0.1 mol C12H22O11在一定条件下完全水解生成的葡萄糖分子数目为0.2NA |
| D、4.6 g金属钠与足量氧气反应被氧化成Na2O和Na2O2,生成物中阴离子个数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com