
| A. | NH4+、Ba2+、Brˉ、CO32ˉ | B. | Clˉ、NO3ˉ、Fe2+、H+ | ||
| C. | K+、Na+、SO42ˉ、MnO4ˉ | D. | Na+、H+、SO42ˉ、HCO3ˉ |
分析 A.钡离子与碳酸根离子反应生成碳酸钡沉淀;
B.硝酸根离子在酸性条件下能够氧化亚铁离子;
C.四种离子之间不反应,能够共存;
D.氢离子与碳酸氢根离子反应.
解答 解:A.Ba2+、CO32-之间反应生成碳酸钡沉淀,在溶液中不能大量共存,故A错误;
B.NO3-、Fe2+、H+之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.K+、Na+、SO42-、MnO4之间不发生反应,在溶液中能够大量共存,故C正确;
D.H+、HCO3-之间反应生成二氧化碳气体,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
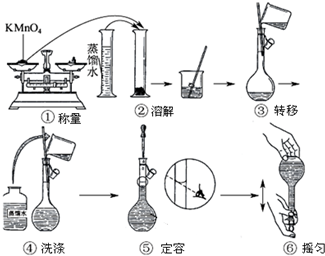
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,可用玻璃棒搅拌漏斗中的液体以加快过滤速率 | |
| B. | 用湿润的pH试纸测溶液的pH,因溶液被稀释而使测量值变大 | |
| C. | 酸碱滴定管、容量瓶、分液漏斗使用前必须检查是否漏水 | |
| D. | 酸碱滴定实验中,需用待滴定溶液润洗锥形瓶以减小实验误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中毒过程中NO2-表现还原性 | |
| B. | 中毒过程中Fe2+表现氧化性 | |
| C. | 解毒过程中维生素C具有还原性 | |
| D. | 解毒过程中维生素C把Fe2+氧化为Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下的某 NaF 溶液中,c(H+)=1×10-10 mol?L-1,说明 NaF 使水的电离减弱 | |
| B. | Mg 在空气中燃烧时发出耀眼的白光,一部分化学能转化为光能 | |
| C. | 纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 | |
| D. | 反应 N2(g)+3H2(g)═2NH3(g)(△H<0)达平衡后,降低温度,正、逆反应速率都减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | Cl2有漂白性 | Cl2能使品红溶液褪色 |
| C | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |
| D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)-1.9KJ可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S(s)+O2(g)═SO2(g)+297.23 kJ,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| D. | 在稀水溶液中 H+(aq)+OH-(aq)═H2O(l)+57.3 kJ,将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的溶液混合时,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

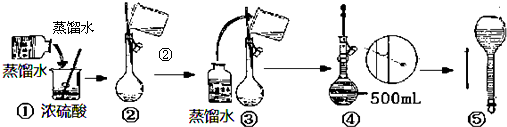
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CO2,溶液pH减小 | |
| B. | 加入少量NH4Cl固体,平衡向正反应方向移动 | |
| C. | 慢慢升高温度,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$逐渐减小 | |
| D. | 加入NaOH 固体后冷却到室温,溶液的KW=c(OH-)•c(H+)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com