
分析 X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素,据此解答.
解答 解:X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素.
(1)由上述分析可知,X为O元素,Y为Cl元素,M为H元素,故答案为:O;Cl;H;
(2)①N的氧化物为SiO2,与NaOH溶液反应离子方程式为:SiO2+2OH-=SiO32-+H2O,
②Si单质与NaOH溶液反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:SiO2+2OH-=SiO32-+H2O;Si+2OH-+H2O=SiO32-+2H2↑;
(3)S与Cl相比,非金属性较强的元素是Cl,可以证明该结论的实验是(用离子方程式表示):Cl2+S2-=2Cl-+S↓,故答案为:Cl;Cl2+S2-=2Cl-+S↓.
点评 本题考查结构性质位置关系综合应用,难度不大,注意元素金属性与非金属性强弱比较实验事实,注意硅及二氧化硅性质的特殊性.


科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
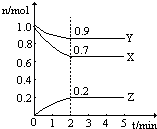 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中消耗铝的质量相同 | |
| B. | 反应中转移的电子数相同 | |
| C. | 反应中消耗的HCl与NaOH物质的量相同 | |
| D. | 溶液增加的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | “钴酞菁”分子(直径为1.3×10-9米)在水中形成的分散系能产生丁达尔效应 | |
| D. | 冰醋酸、铝热剂、硫酸钡、SO2分别属于酸、混合物、强电解质、非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com