
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s) 3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
| A.容器中Fe2O3的质量不随时间而变化 | B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 | D.容器中气体的压强不随时间而变化 |
(1)CH4(g)+H2O(g) =" CO" (g)+3H2 (g) △H=+206kJ?mol-1(2分)
(2)①A D(2分,少选、错选均为0分)
② 0.375 mol/(L?min)(2分)75% (1分) 27(2分)
解析试题分析::(1)4g甲烷完全反应吸收51.5KJ热量,16g甲烷和水反应吸收热量为206KJ;反应的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206KJ/mol;
(2)①A中容器中Fe2O3的质量不随时间而变化,说明反应达到平衡,故A符合;B中平衡时,正逆反应都进行只是正反应速率和逆反应速率相同,故B不符合;C中一氧化碳和二氧化碳的物质的量之比和起始量有关,n(CO):n(CO2)不一定为1:1,故C不符合;D在反应是气体体积不变的反应,平衡时容器中气体的压强不随时间而变化,故D正确;
② 3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)
起始(mol) 4 0
变化(mol) x x
平衡(mol) 4-x x
容器内气体的密度为40g/L: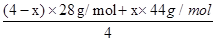 =40g/L计算得到x=3mol;
=40g/L计算得到x=3mol;
该时间范围内反应的平均反应速率υ(CO2)= =0.375mol/L;
=0.375mol/L;
CO的平衡转化率=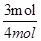 ×100%=75%
×100%=75%
考点:考查热化学方程式的书写,盖斯定律的计算应用,化学平衡的特征分析,利用化学平衡的三段式计算反应速率,转化率。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中, 反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。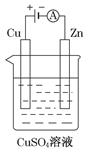
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(5分)某实验小组同学进行如下实验,以探究化学反应中的能量变化。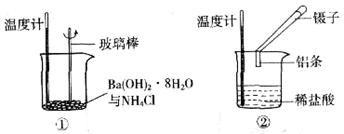
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是____________(填“吸热”或“放热”)反应。
(2)实验②中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是____________(填“吸热”或“放热”)反应,其能量变化可用下图中的____________(填“B”或“C”)表示。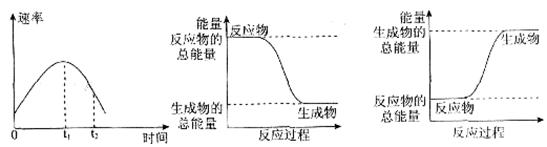
图A中0一tl段化学反应速率变化的原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
①该反应的△H 0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
③某温度下,将0.1 mol CO和0.3 mol H2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: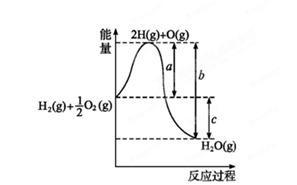
①试写出a、b、c分别代表的意义:
a ;
b ;
c 。
②该反应是 反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+ O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
H2(g)==H2(l) ΔH="-0.92" kJ·mol-1
O2(g)==O2(l) ΔH="-6.84" kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g)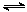 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)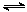 CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示: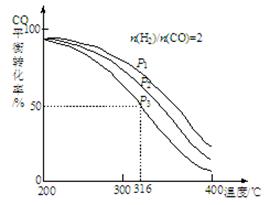
①该反应的平衡常数表达式为 ;P1、P2、P3由大到小的顺序为 。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率 50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,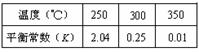
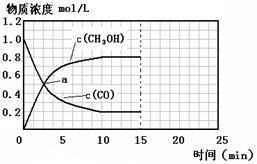
250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为 (从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。
(1)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)=H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
(2)下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),
c电极上发生的电极反应式是 。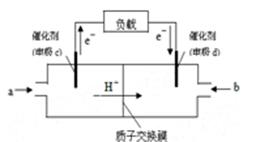
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是红磷P(s)和Cl2反应生成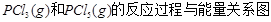 (图中的
(图中的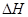 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:
(1)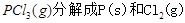 的热化学方程式为 。
的热化学方程式为 。
(2)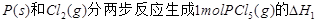 = KJ·mol-1
= KJ·mol-1
(3)研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单地理解为断开1mol化学键时所需吸收的能量,表1所列是部分化学键的键能数据。
表1部分化学键的键能数据
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 198 | 360 | 498 | x |
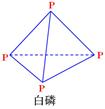 (P4O10)
(P4O10)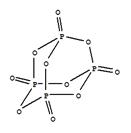
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com