
【题目】化合物(NH4)xFey(SO4)m是一种重要的化工原料。某实验小组为探究该物质的组成,进行如下实验:
(1)探究铁元素化合价
A.甲同学认为铁可能只有+3价;
B.乙同学认为铁可能只有+2价;
C.丙同学认为铁的化合价________________________________。
请设计实验,证明丙同学的结论:______________________________________。
(2)三位同学通过实验证明,铁的化合价为+2价。为了进一步探究该化合物的组成,设计了如下实验:
①准确称取4.36g样品,配制成100.00mL溶液A;
②准确量取20.00mL溶液A,用0.0200 mol·L-1的酸性KMnO4标准溶液滴定其中的Fe2+离子,消耗标准溶液的体积为40.00 mL;
③测定NH4+的含量;另取20.00mL溶液A,加入足量的NaOH溶液并充分加热,用100mL0.10 mol/L的稀盐酸吸收,再用0.10mol/LNaOH标准溶液滴定吸收液,消耗NaOH的体积为60mL。
Ⅰ.写出步骤②中发生的离子方程式__________________________________。
Ⅱ.步骤③中,加入NaOH溶液发生的化学反应方程式______________________________;加入的指示剂是_____________________,判断滴定终点的现象为_____________________,若滴定管在使用前未用NaOH标准溶液润洗,测得的NH4+含量将_____________(填“偏高”、“偏低”或“不变”)。Ⅲ. (NH4)xFey(SO4)m的化学简式为_________________________。
【答案】 既有+2价又有+3价 分别取少量待测液于2支试管中,一支加入KSCN溶液,若溶液变红,则存 在Fe3+,另一支加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成则有Fe2+ 5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O (NH4)2Fe2(SO4)3+6NaOH![]() 2NH3↑+2H2O+2Fe(OH)2↓+3Na2SO4 甲基橙 加入最后一滴NaOH标准溶液,溶液由红色变为橙色且30s不恢复原来颜色 偏低 (NH4)2Fe2(SO4)3
2NH3↑+2H2O+2Fe(OH)2↓+3Na2SO4 甲基橙 加入最后一滴NaOH标准溶液,溶液由红色变为橙色且30s不恢复原来颜色 偏低 (NH4)2Fe2(SO4)3
【解析】试题分析:本题考查物质检验方案的设计,Fe3+、Fe2+的检验,方程式的书写,酸碱中和滴定和误差分析,化学式的确定。
(1)Fe元素常见的化合价有+2价和+3价,甲同学认为铁可能只有+3价,乙同学认为铁可能只有+2价,则丙同学认为铁的化合价既有+2价又有+3价。检验Fe3+用KSCN溶液,检验Fe2+用K3[Fe(CN)6]溶液,要证明丙同学结论的实验设计为:分别取少量待测液于2支试管中,一支加入KSCN溶液,若溶液变红,则存在Fe3+;另一支加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成则有Fe2+。
(2)I.步骤②中用酸性KMnO4溶液滴定Fe2+,酸性KMnO4将Fe2+氧化成Fe3+,KMnO4自身被还原成Mn2+,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
II.根据步骤②和离子反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,20.00mL溶液A中含n(Fe2+)=5n(MnO4-)=5![]() 0.02mol/L
0.02mol/L![]() 0.04L=0.004mol;根据步骤③,吸收NH3后过量的n(HCl)=n(NaOH)=0.10mol/L
0.04L=0.004mol;根据步骤③,吸收NH3后过量的n(HCl)=n(NaOH)=0.10mol/L![]() 0.06L=0.006mol,吸收NH3的n(HCl)=0.10mol/L
0.06L=0.006mol,吸收NH3的n(HCl)=0.10mol/L![]() 0.1L-0.006mol=0.004mol,根据反应NH3+HCl=NH4Cl,20.00mL溶液A中含n(NH4+)=n(NH3)=0.004mol;根据电荷守恒n(NH4+)+2n(Fe2+)=2n(SO42-),20.00mL溶液A中n(SO42-)=0.006mol;则n(NH4+):n(Fe2+):n(SO42-)=x:y:m=0.004mol:0.004mol:0.006mol=2:2:3,(NH4)xFey(SO4)m的化学简式为(NH4)2Fe2(SO4)3。向溶液A中加入足量NaOH溶液,NH4+、Fe2+都发生反应,反应的化学方程式为(NH4)2Fe2(SO4)3+6NaOH
0.1L-0.006mol=0.004mol,根据反应NH3+HCl=NH4Cl,20.00mL溶液A中含n(NH4+)=n(NH3)=0.004mol;根据电荷守恒n(NH4+)+2n(Fe2+)=2n(SO42-),20.00mL溶液A中n(SO42-)=0.006mol;则n(NH4+):n(Fe2+):n(SO42-)=x:y:m=0.004mol:0.004mol:0.006mol=2:2:3,(NH4)xFey(SO4)m的化学简式为(NH4)2Fe2(SO4)3。向溶液A中加入足量NaOH溶液,NH4+、Fe2+都发生反应,反应的化学方程式为(NH4)2Fe2(SO4)3+6NaOH![]() 2NH3↑+2Fe(OH)2↓+3Na2SO4+2H2O。由于用盐酸吸收NH3后的溶中的溶质有NH4Cl和过量的HCl,用NaOH溶液滴定过量的HCl,为了防止NH4Cl与NaOH反应,应选用酸性范围内发生颜色变化的指示剂,加入的指示剂是甲基橙。终点的实验现象是:滴入最后一滴NaOH标准溶液,溶液由红色变为橙色且在30s内不恢复原来的颜色。若滴定管在使用前未用NaOH标准溶液润洗,将导致消耗的NaOH溶液体积偏高,过量的HCl偏高,吸收NH3的HCl偏低,测得的NH4+含量将偏低。
2NH3↑+2Fe(OH)2↓+3Na2SO4+2H2O。由于用盐酸吸收NH3后的溶中的溶质有NH4Cl和过量的HCl,用NaOH溶液滴定过量的HCl,为了防止NH4Cl与NaOH反应,应选用酸性范围内发生颜色变化的指示剂,加入的指示剂是甲基橙。终点的实验现象是:滴入最后一滴NaOH标准溶液,溶液由红色变为橙色且在30s内不恢复原来的颜色。若滴定管在使用前未用NaOH标准溶液润洗,将导致消耗的NaOH溶液体积偏高,过量的HCl偏高,吸收NH3的HCl偏低,测得的NH4+含量将偏低。
III.根据II的计算,(NH4)xFey(SO4)m的化学简式为(NH4)2Fe2(SO4)3。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
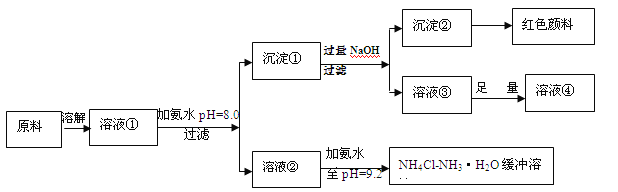
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
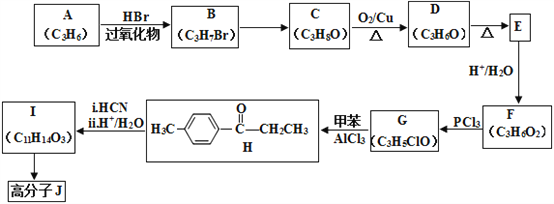
【题目】高分子合物J的合成路线如下:
已知:i. 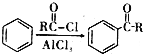
ii. 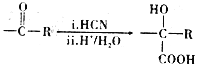
(1)写出A的结构简式:________________________。
(2)由B→C的反应条件为:________________,反应类型为:_________________。
(3)H中官能团名称:________________________。
(4)D 与新制的银氨溶液反应生成E的化学方程式:__________________________________________。
(5)由I合成高分子化合物J的化学方程式为____________________________________。
(6)有机物L(C9H10O3)符合下列条件的同分异构体有___________种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基,且只有一个烷基
(7)结合上述流程中的信息,设计由![]() 制备
制备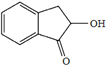 的合成路线。合成路线流程图示例:
的合成路线。合成路线流程图示例:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5,______________________。
CH3COOC2H5,______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机合成中间体的结构简式如图所示。下列关于该有机物的叙述不正确的是

A. 分子式为C9H9O4Br
B. 在一定条件下可与HCHO发生缩聚反应
C. 1 mol该物质与足量NaOH溶液混合加热,最多能消耗4mol NaOH
D. 1 mol该物质与浓溴水反应,最多能消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 将铜插入稀硝酸中:Cu+4H++2NO3–===Cu2++2NO2↑+H2O
B. 向碳酸氢铵溶液中加入足量澄清石灰水:Ca2++![]() +OH–
+OH–![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
D. 向Na2SiO3溶液中滴加稀醋酸:Na2SiO3+2H+===H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是( )
A.Na+、Cu2+、Cl﹣、OH﹣
B.H+、Ca2+、HCO3﹣、NO3﹣
C.Fe2+、H+、SO42﹣、NO3﹣
D.Na+、CO32﹣、OH﹣、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com