
| A、三者对应的氧化物均为碱性氧化物 |
| B、三者的单质放置在空气中只生成氧化物 |
| C、三者的单质在常温均不能和浓硫酸反应 |
| D、制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |


科目:高中化学 来源: 题型:
185 75 |
187 75 |
| A、镍基含铼单晶合金属于金属晶体 | ||||
B、
| ||||
| C、铼(Re)元素的相对原子质量为186 | ||||
| D、含铼合金比纯铼的熔点高、硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在医疗上碳酸氢钠可用于治疗胃酸过多 |
| B、用于高压钠灯成分是钠与钾的合金 |
| C、人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3 |
| D、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| B、相同温度下,等物质的量浓度的Na2CO3和NaHCO3溶液pH:Na2CO3>NaHCO3 |
| C、将两支蘸有浓盐酸和浓氨水的玻璃棒相互靠近有大量白烟产生 |
| D、HCl、NH3、CO2都极易溶于水,都可用水作吸收剂做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见如图).分析图象得到的以下结论中,一定正确的是( )
某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见如图).分析图象得到的以下结论中,一定正确的是( )| A、金属甲比金属乙活泼 |
| B、金属甲比金属乙的相对原子质量大 |
| C、金属乙比金属甲与盐酸的反应速率大 |
| D、金属乙比金属甲的化合价高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在氧气中燃烧发出白色光,生成淡黄色固体 |
| B、铁与稀硫酸反应,产生大量的气体,生成棕黄色溶液 |
| C、氢气在氯气中燃烧产生苍白色烟雾,生成有刺激性气味的气体 |
| D、铜与氯气反应产生棕黄色的烟,加水后溶液呈蓝绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
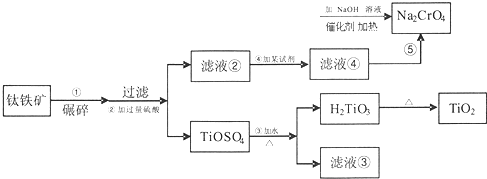
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | NaOH | NaHSO3 | Na2SO3 | SO2 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | NaOH |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
| D | C | CO | CO2 | O2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com