
A.6 s B.4 s C.3 s D.2 s
科目:高中化学 来源: 题型:



| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 催化剂 |
| ||
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 催化剂 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省襄阳市高三调研三月统一测试理综化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。填写下列空白。
A
B C D
(1)写出C的氧化物的一种用途:
(2)B单质与Fe2O3反应时,每消耗13.5g B时放热213kJ,该反应的热化学方程式是
(3)为防止A元素的氧化物AO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
AO2+X催化剂A2 +H2O+n Z(未配平,n可以为0)。上述反应式中的X不可能是 (填标号)。
a.NH3 b.CO c.CH3CH2OH d.H2O2
(4)A元素的最简单氢化物甲、D元素的最高价氧化物对应的水化物乙都是很重要的基础化工原料。
①一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是 (选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
②25℃时,往a mol·L-1的甲的水溶液中滴加0.01 mol·L-1乙溶液,当两种溶液等体积混合时,溶液呈中性(设温度不变)。滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”);
所得混合溶液中A、D两种元素的物质的量的关系为:A 2D(填“大于”、“等于”或“小于”);甲中溶质的电离平衡常数Kb= (用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省德阳市高三第一次诊断性考试化学试卷 题型:填空题
(12分)工业制硝酸的主要反应之一是:
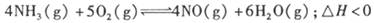
(1) 若反应起始的物质的量相同,下列关系图错误的是________ (填编号)。
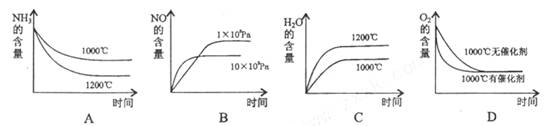
(2) 在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2的平均反应速率为________mol/(L • min)。
②反应在第2min时改变了条件,改变的条件可能是________ (填编号)。
A 增加O2的浓度 B.升高温度 C.减小压强 D.使用催化剂
(3)将一定量铝粉和铁粉的混合物与上述反的稀硝酸充分反应,反应过程中无气体放出(氧化物产生)。在反应结束后的溶液中, 的NaOH溶液,所加NaOH溶液(mL)与产生的沉淀的物质的量关系如图所示则:
的NaOH溶液,所加NaOH溶液(mL)与产生的沉淀的物质的量关系如图所示则:
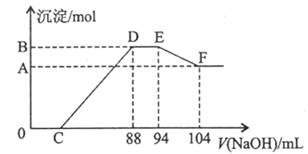
EF段反应的离子方程式是_______________;铁粉的物质的量之比是_____________
酸溶液中含HNO3的物质的量是__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com