
【题目】下列有关物质用途的说法中,正确的是
①Si可用来制造半导体材料 ②SiO2可用于制造光导纤维 ③Al(OH)3可用于治疗胃酸过多 ④氧化铁可用于制红色涂料
A.只有①B.只有②C.只有③D.都正确
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】2017年9月我国科学家对于可充放电式锌一空气电池研究取得重大进展。电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电的总反应方程式为2Zn+O2+40H-+2H2O=2Zn(OH)2。下列有关说法正确的是( )

A. 可逆锌一空气电池实际上是二次电池,放电时电解质溶液中K+向负极移动
B. 在电池产生电力的过程中,空气进入电池,发生ORR反应,并释放OH-
C. 发生OER反应的电极反应式为2H2O-4e-=O2+4H+
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是___________________________。
(2)C2B的电子式是__________________。
(3)B、C、E的离子半径由大到小的顺序为__________________(用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为_________________。
(4)B的气态氢化物与H2S相比沸点高的是_________(用化学式回答);原因是___________。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点。已知铊有两种天然同位素![]() 和
和![]() 。下列关于
。下列关于![]() 说法正确的是( )
说法正确的是( )
A. 中子数与质子数之差为122B. 中子数与电子数之差为122
C. 质量数与中子数之差为81D. 质量数与电子数之差为81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2所示装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
②_________________________________________________。
(2)能说明有SO2气体产生的实验现象是_________________________。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴人适量水中为试样,试样中所含金属离子的成分有以下三种可能:
I.只含有Fe3+;II.只含有Fe2+;III.既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀盐酸溶液 B.稀硫酸溶液 C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉—KI溶液 G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的____________(填试剂序号,下同),振荡,再滴加少量的___________,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤l 取试样,滴加少量的______________(填试剂序号),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________。
步骤2 再取适量的试样滴加少量的_______________________ (填试剂序号),溶液的颜色变为_____________,则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式__________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为____。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
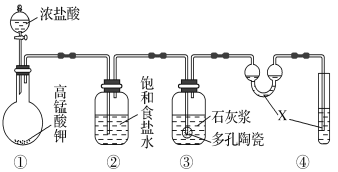
(1)装置④中的X试剂为_____________________。
(2)装置③中发生反应的化学方程式为_______________________,
(3)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它的制备方法如下图所示,下列说法正确的是
![]()
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 灼烧熔融的Na2CO3固体,可用石英坩埚
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点67.6℃),可通过蒸馏(或分馏)提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为____________________________________。
(2)温度为T时,向5L恒容密闭容器中加人80g CuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=_____________________。
②5min时缩小容器容积,重新达到平衡时O2的浓度_________(填“增大”“减小”或“不变”)。
③其他条件不变,起始向该容器中充入0.5molCuO,重复实验,达到平衡的时间_____2.5min(填“大于”“小于”或“等于”);达到平衡时Cu2O的物质的量______0.2mol(填“大于”“小于”或“等于”)。
(3)研究表明,在CuO中加入适量碳粉,下列说法中有利于制得纳米级Cu2O的是_____(填选项字母)。
A.碳与氧气反应放热,加快反应速率
B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉
D.CO作该反应的催化剂
II.CuO可用于冶炼铜(已知:CO的燃烧热△H=-283kJ/mol),一定条件下,将1molCuO和0.5molCO加人2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
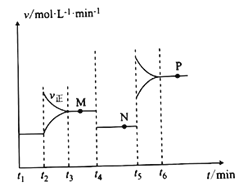
(4)t4时改变的条件为______________________________________________。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com