
【题目】写出下列反应的化学方程式
(1)钠在空气中加热__________________________________
(2)工业制漂白粉__________________________________
(3)氯气通入水中__________________________________
(4)次氯酸见光分解__________________________________
【答案】2Na+O2![]() Na2O22Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。Cl2+H2OH
Na2O22Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。Cl2+H2OH![]() HCl+HClO2HClO
HCl+HClO2HClO ![]() 2HCl+O2
2HCl+O2
【解析】
本题考查钠及氯气的性质。钠是活泼的金属,在空气中加热生成过氧化钠;氯气是活泼的非金属单质,能和碱反应制取漂白粉,氯气还可以和水反应生成次氯酸和氯化氢,次氯酸不稳定见光易分解。根据性质完成相关的反应方程式。
(1) 钠在空气中加热生成过氧化钠,方程式为: 2Na+O2![]() Na2O2。
Na2O2。
(2) 工业制漂白粉用的是石灰乳和氯气反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O。
(3) 氯气通入水中会和水反应生成氯化氢和次氯酸,反应方程式为:Cl2+H2O![]() HCl+HClO
HCl+HClO
(4) 次氯酸见光分解易生成盐酸和氧气。其反应方程式为2HClO ![]() 2HCl+O2↑
2HCl+O2↑


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A. CO2的电子式:![]() B. 质量数为37的氯原子:
B. 质量数为37的氯原子:![]() l
l
C. NH4Cl的电子式:![]() D. 原子核内有10个中子的氧原子:
D. 原子核内有10个中子的氧原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
如图是制取溴苯的装置。试回答:

(1)装置A中发生反应的化学方程式是_________________________。
(2)装置C中看到的现象是____________________,证明________________________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是________,原因是____________。
如果没有B装置而将A、C直接相连,你认为是否妥当?________(填“是”或“否”),理由是______________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯______________(填“上”或“下”)层为溴苯,这说明溴苯______________且______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A. K+不一定存在 B. Ba2+、Mg2+不一定都存在
C. Cl-不一定存在 D. 混合溶液中CO32-的浓度为0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
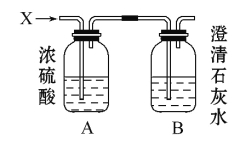
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是 。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是 。
(3)若A、B两个洗气瓶的质量都增加,试推测X可能有几种组合,填写下表。(有多少种写多少种,不必填满)
组合 | ① | ② | ③ | ④ | ⑤ | ⑥ |
X |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只含SiO2杂质的石灰石样品,在高温下熔烧得到的残留物经检验为一纯净物,则原样品中SiO2的质量分数为( )
A. 28.5% B. 37.5% C. 40% D. 62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
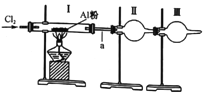
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
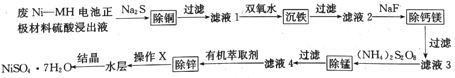
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
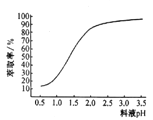
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
③“操作X”的名称是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:
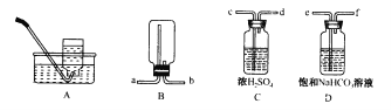
(1)实验室利用A装置收集氧气的最佳时刻是_________________________。
(2)用收集到的氧气完成硫粉燃烧实验后,还需向集气瓶内加入适量氢氧化钠溶液,目的是_______________________(用化学方程式表示)。
(3)实验室制取二氧化碳若用B装置收集,则气体应从________端进入,制取的二氧化碳中常含有少量的氯化氢气体与水蒸气,欲使用C、D装置将以上杂质除去,则装置正确的连接顺序是_____________(用C、D装置端口字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com