
| A. | a+3b | B. | $\frac{a}{2}$+3b | C. | $\frac{a}{2}$+3b+$\frac{7w}{2}$ | D. | $\frac{a}{2}$+3b-$\frac{7w}{2}$ |
分析 加成反应前后原子守恒,amol H2和bmol C2H4混合,C原子为2bmol,H原子为4bmol+2amol,以此计算完全燃烧消耗的氧气.
解答 解:加成反应前后原子守恒,amol H2和bmol C2H4混合,C原子为2bmol,H原子为4bmol+2amol,
由C~O2、4H~O2,
则消耗的氧气为2bmol+(4bmol+2amol)×$\frac{1}{4}$=3bmol+$\frac{a}{2}$mol,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握加成反应规律及原子守恒为解答的关键,侧重分析能力及计算能力的考查,注意完全燃烧生成二氧化碳和水,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
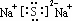 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
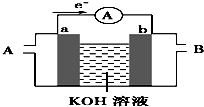 (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
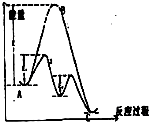
| A. | 使用正催化剂能够加快反应的速率,根本上是由于催化剂参与反应,并且同等程度地降低了正逆反应的活化能 | |
| B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑△H>0,该反应过程可用该图象表示 | |
| C. | 使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO═2CO2+N2 | |
| D. | 化学反应的本质是旧键断裂,新键形成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O | |
| B. | 在NaHSO4溶液中加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸:2OH-+CO32-+4H+=CO2↑+2H2O | |
| D. | 苏打溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com