
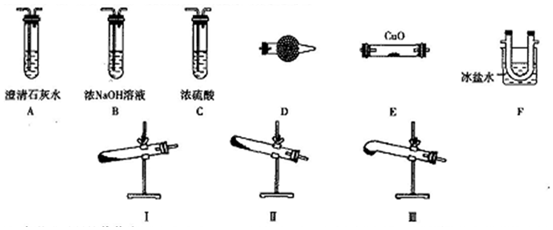
分析 (1)根据草酸受热易融化分析;验证草酸分解产物,先检验生成的水,通过干燥管D,草酸易升华,通过E装置冷凝,防止干扰后续的检验,再通过澄清的石灰水检验生成的二氧化碳气体,为防止二氧化碳对一氧化碳的干扰,故要除净二氧化碳,选择氢氧化钠溶液,再通过浓硫酸干燥二氧化碳气体,最后通入E装置与氧化铜反应;
(2)无水硫酸铜检验水,CO与氧化铜反应生成二氧化碳和铜单质,据此分析;
(3)先分解草酸;尾气为CO,根据CO可燃和难溶于水的性质处理;
(4)草酸分解为CO、CO2、H2O,根据原子守恒书写;
(5)根据弱酸形成的强碱弱酸盐是否水解或者与等浓度的强酸酸性强弱比较分析.
解答 解:(1)草酸受热易融化,试管底部高于试管口部易堵塞,故选择I(或III);验证草酸分解产物,先检验生成的水,通过干燥管D,草酸易升华,通过E装置冷凝,防止干扰后续的检验,再通过澄清的石灰水检验生成的二氧化碳气体,为防止二氧化碳对一氧化碳的干扰,故要除净二氧化碳,选择氢氧化钠溶液,再通过浓硫酸干燥二氧化碳气体,最后通入E装置与氧化铜反应,装置顺序为:D→F→A→B→C→E或D→F→A→B→A→C→E;
故答案为:I(或III);D→F→A→B→C→E或D→F→A→B→A→C→E;
(2)装置D为检验水的装置,选择无水硫酸铜,变蓝色可证,CO与氧化铜反应生成铜和二氧化碳,若有CO,则E中固体由黑色变成红色,E右侧的澄清石灰水变浑浊;
故答案为:无水CuSO4;E中固体由黑色变成红色,E右侧的澄清石灰水变浑浊;
(3)加热顺序为:先加热装置I(或III),后加热装置E;尾气为CO,可采用排水法收集尾气或将尾气燃烧掉;
故答案为:先加热装置I(或III),后加热装置E;用排水法收集尾气或将尾气燃烧掉;
(4)若上述实验均产生了预期的现象,写出草酸分解的化学方程式为:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+3H2O;
故答案为:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+3H2O;
(5)验证草酸为弱酸的方案为:测量Na2C2O4溶液的pH,pH>7或向等物质的量浓度的盐酸和草酸溶液中各滴入2滴心蕊试液,草酸溶溶中红色浅一些;
故答案为:测量Na2C2O4溶液的pH,pH>7或向等物质的量浓度的盐酸和草酸溶液中各滴入2滴心蕊试液,草酸溶溶中红色浅一些.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,难度较大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌和盐酸生成氢气 | B. | 氯酸钾和二氧化锰生成氧气 | ||
| C. | 碳酸钙和盐酸生成二氧化碳 | D. | 氯化钠和浓硫酸生成氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定为1:1 | B. | 可能为2:3 | C. | 一定为3:2 | D. | 可能为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
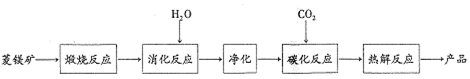
| 消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
| 物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| Ksp | 10-11 | 10-39 | 10-17 | 10-14 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
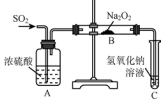 (1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:
(1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 纯净的H2在Cl2中燃烧 | 安静地燃烧,并发出苍白色火焰 | 说明燃烧不一定需要氧气参加 |
| B | 分别将蘸有浓氨水和浓硫酸的玻璃棒靠近 | 产生白烟 | NH3能和酸反应生成了相应的铵盐 |
| C | 把SO2通入高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色 | 说明SO2只具有漂白性 |
| D | 高温下,SiO2与纯碱混合加热,产生气体通入澄清石灰水 | 石灰水变浑浊 | 说明硅酸的酸性比碳酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2试样已变质 |
| B | 向甲苯中滴加少量酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | 甲苯发生了氧化反应 |
| C | 常温下分别测定浓度均为0.1mol/L的Na2SiO3溶液和Na2CO3溶液的pH | pH:Na2SiO3>Na2CO3 | 非金属性:Si>C |
| D | 将少量某无色气体通入澄清石灰水中 | 出现白色沉淀 | 该气体一定是CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为Fe,负极为Zn,电解质溶液为Fe2(S O4)3
O4)3
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com