
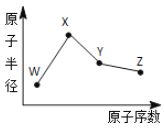
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W 一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
(1)X元素位于元素周期表中位置为_____________。
(2)X的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。Z所在族的简单氢化物中,沸点最高的是________(写化学式),原因为______________________。
(3)W、X、Z三种元素形成的化合物中化学键类型为_______;X2W2的电子式为_______。
(4)Z的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为___________。M可与NaOH溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________。
【答案】第三周期第IA族 Si HF HF分子间能形成氢键 离子键、共价键 ![]() ClO2 6ClO2+6NaOH=NaCl+5NaClO3+3H2O
ClO2 6ClO2+6NaOH=NaCl+5NaClO3+3H2O
【解析】
W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;在Z所在的周期中,Z元素的原子得电子能力最强,则Z是Cl元素,Y的原子半径介于X和Z之间,四种元素的最外层电子数之和为18,则Y是Si元素,以此解答该题。
根据上述分析可知W是O,X是Na,Y是Si,Z是Cl元素。
(1)X是Na元素,核外电子排布是2、8、1,可知Na元素位于元素周期表中位置为第三周期第IA族;
(2)X是Na,属于金属晶体,Na+与自由电子之间通过金属键结合,Y是Si,属于原子晶体,原子间通过共价键结合,共价键是一种强烈的相互作用,比金属键作用强,因此Na的单质和Si的单质相比,熔点较高的是Si单质;Z是Cl元素,位于第VIIA,在该族的简单氢化物中,由于HF分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的吸引力,使物质的熔沸点升高,故第VIIA元素形成的氢化物中,沸点最高的是HF;
(3)W、X、Z三种元素形成的化合物如NaClO中化学键类型为离子键、共价键;化合物X2W2是Na2O2,该物质是含有非极性共价键的离子化合物,其的电子式为![]() ;
;
(4)M中Cl、O原子个数比为![]() :
:![]() =1:2,所以化学式为ClO2,在ClO2中Cl元素的化合价为+4价,M可与NaOH溶液发生氧化还原反应生成两种稳定的盐,它们的物质的量之比为 1︰5,根据化合价升降代数和等于0,可得该反应的化学方程式为6ClO2+6NaOH=NaCl+5NaClO3+3H2O。
=1:2,所以化学式为ClO2,在ClO2中Cl元素的化合价为+4价,M可与NaOH溶液发生氧化还原反应生成两种稳定的盐,它们的物质的量之比为 1︰5,根据化合价升降代数和等于0,可得该反应的化学方程式为6ClO2+6NaOH=NaCl+5NaClO3+3H2O。


科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号)。

(1)芳香烃:_____________ ;
(2)卤代烃:_____________;
(3)醇:_______________ ;
(4)酚:_____________;
(5)醛:_______________ ;
(6)酮:_____________;
(7)羧酸:_____________ ;
(8)酯:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
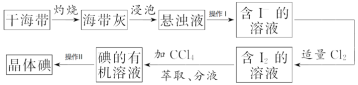
【题目】如图是海带中提取碘的流程图:
回答下列问题。
(1)干海带在_____________________中灼烧(填仪器名称)
(2)操作I名称为_____________________
(3)分液漏斗在使用前须清洗干净并_____________________,在本实验分离过程中,碘的四氯化碳应该从分液漏斗的_____________________(填“上口倒出”或“下口放出”)
(4)操作II名称为_____________________,该操作中加入碎瓷片的作用是_____________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____________________(填标号)。
A.立即补加B.冷却后补加C.不需补加D.重新配料
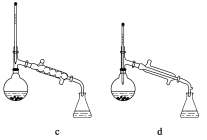
(5)在操作II中,仪器选择及安装都最合理的是_____________________(填标号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素的单质及其化合物之间的转化关系:NH3N2NO NO2HNO3。回答下列问题:
(1)N元素在元素周期表中的位置为_______;
(2)上述四种气体只能用排水法收集的是_______(填化学式,下同),只能用排空气法收集的是______;
(3)氮的氧化物是空气的主要污染物,下列环境问题与氮的氧化物排放有关的是_____;
A. 酸雨 B. 光化学烟雾 C. 白色污染 D. 臭氧层空洞
(4)NO2形成酸雨的化学方程式为______;
(5)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程______;
(6)若将12.8 g铜与 50 mL一定浓度的浓硝酸反应,两者恰好完全反应共产生气体5.6 L(标准状况),计算此浓硝酸的物质的量浓度_______(写出解题过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________(填元素符号);
(2)③的气态氢化物的电子式________,②与④形成的气态化合物的结构式_________;
(3)这些元素形成的最高价氧化物的水化物中,碱性最强化合物的电子式:__________; 酸性最强的含氧酸为__________(填物质的化学式);
(4)②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式_______;
(5)⑥的单质和⑤的最高价氧化物对应的水化物反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 浓度是影响化学反应速率的本质因素
B. 在容积可变的密闭容器中,发生反应H2(g)+I2(g) ![]() 2HI(g),把容积缩小一倍,正反应速率加快,平衡正向移动
2HI(g),把容积缩小一倍,正反应速率加快,平衡正向移动
C. 反应 MgCl2(l)=Mg(l)+Cl2(g)的 △H<0、△S>0
D. 化学反应速率可用单位时间内反应物的浓度变化量来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
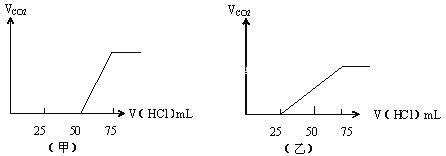
【题目】有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:
试
(1)NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是甲:________,其物质的量之比是:________;乙:__________,其物质的量之比是:__________。
(2)且在两种情况下产生的CO2气体(标准状况)各是甲:________mL;乙:_________mL。
(3)原NaOH溶液的物质的量浓度是_________;若以Na2O2固体溶于水配得100mL溶液需称量Na2O2_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中的位置如图所示。下列推断正确的是( )

A. 原子半径:Z>Y>X
B. 元素非金属性:Z>Y>X
C. 最高价氧化物对应水化物的酸性:Z>Y>W
D. WH4与Z元素的单质在光照时发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入新制氢氧化铜悬浊液,能否实现实验目的_________(填”能”或”否”),若不能,其原因是_________,最简单的改正措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com