

分析 无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含Fe3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、NH4+、H+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(H+),再根据电荷守恒确定有没有NO3-.
解答 解:(1)无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含Fe3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Na+、Al3+、NH4+、H+、SO42-,废水中一定不存在的离子有Fe3+、Mg2+、CO32-,
故答案为:Fe3+、Mg2+、CO32-;
(2)氢氧化铝能溶于氢氧化钠中,即Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)已知硫酸钡沉淀为2.33g,则n(SO42-)=$\frac{2.33g}{233g/mol}$=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.007mol,
Al(OH)3+OH-=AlO2-+2H2O
n(Al3+) 0.007mol
所以n(Al3+)=0.007mol,将铝离子沉淀需要氢氧化钠0.021mol,所以溶液中H+消耗氢氧化钠0.014mol,氢离子的物质的量是0.014mol,
NH4++OH-=NH3•H2O,消耗氢氧化钠0.007mol,所以铵根离子的物质的量是0.007mol,原溶液中c(NH4+)与c(Al3+)的比值为1:1,
铝离子0.007摩尔带0.021摩尔正电荷,氢离子0.014摩尔,铵根离子0.007摩尔,正电荷总物质的量超过0.042摩尔,而硫酸根只有0.01摩尔,带0.02摩尔负电荷,所以根据电荷守恒,必然有硝酸根离子,
故答案为:1:1;存在.
点评 本题考查了常见离子检验,现象的判断和离子检验,关键是图象分析离子特征和离子共存的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向带有氧化膜的铝片中加入盐酸 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向漂白粉浊液中通入过量CO2 | |
| D. | 向NaOH溶液中加入过量AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8、C3H6 | B. | C2H2、C3H8 | C. | C2H4、C3H6 | D. | C2H6、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.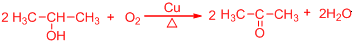 .
. 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.
 (其中两种)
(其中两种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 热化学方程式 | 结 论 | |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol | 氢气的燃烧热△H=-483.6 kJ/mol |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.3 kJ/mol | 含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C. | 2C(s)+2O2(g)═2CO2(g)△H=-a kJ/mol 2C(s)+O2(g)═2CO(g)△H=-b kJ/mol | b>a |
| D. | C (石墨,s)═C (金刚石,s)△H=+1.5 kJ/mol | 金刚石比石墨稳定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终得到白色沉淀和无色溶液 | |
| B. | 最终得到的白色沉淀是等物质的量的两种化合物的混合物 | |
| C. | 混合过程中,逸出无色气体 | |
| D. | 在最终得到的溶液中,c(Cu2+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com